1934年,一位48岁的德国面包师因进行性呼吸困难、紫绀和肺水肿死亡,肺静脉闭塞的组织病理学改变作为其死因,第一次被描述(1)。1966年英国病理学家Donald Heath和他的同事(2)第一次提出肺静脉闭塞症(PVOD)是一个独立的疾病,而不是一个偶然的尸检发现。在对一名37岁女性患者进行了详尽的解剖后,他发现患者95%的肺静脉和微静脉存在闭塞性改变,这让他提出,“无论这种情况的病因是什么,毫无疑问,由于其组织病理学上存在肺静脉和肺泡壁广泛受累,应将其与经典的原发性肺动脉高压区分开来”(3)。10年后,荷兰病理学家C. A. Wagenvoort(4)和他的同事(5)提出PVOD是一种获得性的破坏性静脉血栓形成综合征,是由于静脉内皮细胞的广泛损伤引起的。今天,PVOD的年发病率估计为每百万人0.1-0.2例(1)。PVOD患者的年龄范围很广,从9天到60-70岁,但主要见于儿童和年轻人(1,6)。其中30%- 50%的患者小于20岁,并且没有性别上的差异。但在成年患者中,男性的发生率是女性的两倍(5,7 - 9)。从发病到死亡的病程通常是2年;儿童患者往往病情进展更迅速,短短几个月的时间可进展为右心衰和死亡(7-11)。
肺毛细血管瘤病(PCH)在医学文献中报道的比PVOD少得多。Wagenvoort和他的同事于1978年在一名患有进行性呼吸困难、咯血和出血性胸腔积液的71岁女性患者中首次认识到这种疾病。他们在肺组织中观察到一种独特的“不典型增殖的毛细血管样通道”,这似乎是一种“血管瘤性生长”。PCH患者的年龄范围广泛(2-71岁),平均年龄为30岁,与PVOD患者的年龄范围相当。然而,与PVOD不同的是,PCH在任何年龄(13-15岁)的患者男女患病率均是相同的,其中位生存期为3年,与PVOD一样,在症状出现后几个月就可能死亡(13,15)。
尽管在医学文献中报道了PVOD和PCH与许多其他疾病相关的情况,但是现在两者都被认为是特发性疾病。PVOD在系统性红斑狼疮、硬皮病、系统性硬化症、人类免疫缺陷病毒感染、类风湿性关节炎、雷诺现象、桥本甲状腺炎、朗格汉斯细胞组织细胞增多症或肉芽肿性血管炎患者中偶发,提示疾病的发生可能有免疫介导的原因(10,16 - 25)。同样,PCH也出现在系统性红斑狼疮、硬皮病、大动脉炎、卡塔格内综合征或肥厚性心肌病的患者中(15,19)。几个PVOD患者叙述了其得病近期的病毒感染史,提示病毒感染可能是疾病的病因(1,10)。已有三对兄弟姐妹死于PVOD,PCH被认为存在常染色体隐性遗传,这两种情况都提示了疾病存在家族关联性(10,14,26)。PVOD也发生在放疗、化疗(包括博莱霉素、顺铂、长春新碱、卡马司丁和丝裂霉素治疗)、外周血干细胞移植以及自体或异体骨髓移植的癌症患者中(10,27 - 35)。PVOD患者的基础恶性肿瘤疾病包括神经母细胞瘤、肺癌、多发性骨髓瘤、白血病和霍奇金淋巴瘤;在一名既往患有结肠癌的患者中出现PCH(30,31,33,36 - 39)。在这些肿瘤患者中发生PVOD或PCH,由于癌症治疗的毒性损伤还是由于恶性肿瘤的并发症仍有争议,这其中许多问题仍未得到解答。
PVOD和PCH的临床表现均为进行性呼吸困难和疲劳,因此通常被误诊为肺动脉高压(PAH)(1,10,13 - 15)。病人也可能有慢性咳嗽(干咳或咳痰)、胸痛、晕厥、或杵状指(1,6,15)。唯一可以区分PCH和PVOD的临床特征是咯血(30% PCH患者有咯血表现,但PVOD患者中未有报道)和血性胸腔积液(PCH患者中高达25%,PVOD患者中不存在)(12 - 15,40)。当PVOD或PCH进展时,右心衰可引起缺氧、紫绀、低血压、外周水肿、腹水、肝肿大、肝颈静脉回流征阳性和右侧胸骨旁隆起。心电图通常显示电轴右偏和右心室肥厚。超声心动图(M型、多普勒和二维)显示肺动脉高压,有助于排除潜在的左心结构性病变(如二尖瓣狭窄或粘液瘤)或左心室功能障碍(7 - 10,16,41,42)。据估计,5%-25%的PVOD患者被误诊为特发性肺动脉高压或肺血栓栓塞性疾病(1,7,8,10,11,41,43)。绝大多数PCH患者在移植或死亡前被误诊为原发性肺动脉高压(PPH)、PVOD、肺纤维化、结节病、肺血栓栓塞或肺铁血黄素沉着症(15)。
PVOD和PCH有两个血流动力学特征:肺动脉压升高以及肺毛细血管楔压(PCWP)正常或减低。几乎所有PVOD和PCH患者在右心导管检查中都有肺动脉压升高,这一发现证实了肺动脉高压的存在,并可能误导临床医生的诊断(1,6 - 9,15,16,28,42,44 - 46)。这种PAH进一步由肺小动脉中央肥大、肺动脉主干扩张和右心室肥大证实,可以通过肺静脉(如PVOD)或毛细血管床(如PCH)持续反射的压力升高来解释(47)。
第二个血流动力学特征是正常或减低的PCWP。PCWP这个术语实际上是不准确的,因为并没有实际评估毛细血管床的压力。实际测量的为导管的楔型尖端处的压力,其超越肺静脉和小静脉到达最大的肺静脉和左心房,而这些结构在PVOD和PCH中均不受影响(1,6 - 8,16,46,48 - 51)。在大多数情况下,PCWP的测量低估了毛细血管床本身的压力(51)。理论上,PVOD对肺静脉和小静脉有不同程度的影响,在PCWP测量时,部分并行的支气管静脉和未闭的静脉支提供了正常的静脉血流出到大静脉和左心房。PVOD或PCH中观察到的PCWP正常或减低有助于临床中的鉴别诊断,它们与大肺静脉阻塞或狭窄、左房黏液瘤、二尖瓣狭窄或左室衰竭患者的PCWP升高形成直接对比(52)。
特别是PVOD的血流动力学异常也可能出现毛细血管静水压力超过血液的渗透压,这种状态导致液体渗入间质(即肺水肿),继而出现胸膜下和小叶间隔淋巴管的充盈和扩张。PVOD的临床三联征(PAH, PCWP正常至减低,以及小叶间隔明显增厚)已被充分证实,尽管在现实中,许多患者只有一个物理或放射学的发现来提示诊断(1,6,53)。
PVOD的胸部x线表现通常包括肺动脉高压和毛细血管后充血的特征:主肺动脉增粗和小叶间隔增粗(Kerley B)共同表明原发疾病超出了肺动脉循环(图1,2)。通过肺静脉口径正常和左房左室轮廓正常,进一步将病变定位于肺静脉。可能存在胸腔积液。多灶性气腔实变的发生是罕见的,其不同程度地对应于肺实质出血、肺水肿或肺梗死(6 -9、11、16、28、41、43、44、48、52、54、55)。
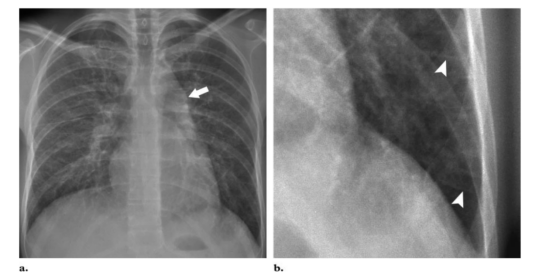
图1所示。PVOD, 20岁男性,(a)后前位胸片示肺动脉干突出(箭头),叶间裂增厚,Kerley B线(箭头)。(B)左肺下叶平片进一步确认Kerley B线的存在。
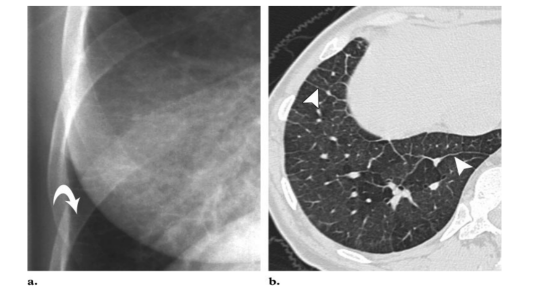
图2。PVOD, 56岁女性。(a) 右肺下叶平片可见大量Kerley B线(箭)。(B)轴向CT(肺窗水平)右肺下叶平滑增厚的小叶间隔(箭头)和地图状毛玻璃密度影。
PVOD CT扫描显示肺动脉主干扩张,伴广泛、光滑的小叶间隔增厚(图2b、3a、4),进一步显示为弥漫性、地图样、马赛克样、肺门周围、斑片状或小叶中心分布的磨玻璃密度影(图2b、3a)。肺动脉主干突出,右心室可能增大,符合肺心病表现(56-58)(图3c, 4)。左心房和心室外观正常。Swensen等(57)在一项对8例PVOD患者的研究中发现,50%或以上的患者CT检查显示小叶间隔增厚、叶间裂增厚,肺动脉干增粗、肺静脉口径正常,双侧胸腔积液或肺马赛克征。Resten等(59)认为小叶间隔线和边界不清的小叶中心毛玻璃密度影是区分PVOD (n=15)和PPH (n=15)最有帮助的两个CT表现。虽然淋巴结肿大在PVOD中出现的概率不确定,但是它被认为是区分PVOD和PPH的一个有用的发现,同时它在慢性血栓栓塞性肺高压和左心衰竭中也可能出现(6,57 - 60)。Resten等(59)报道,PVOD和PPH在胸腔积液或心包积液出现的频率上均无显著差异。
PVOD的肺动脉造影显示肺动脉中央动脉扩张,远端动脉分支轻微狭窄,无动脉充盈缺损,肺实质期不均匀,肺循环时间延长。肺静脉正常或显示不佳,左心房正常或减小,无充盈缺损(11,28,41,43,48,49,61)。
在PVOD中,通气-灌注扫描的表现很广泛,从正常到弥漫性不规则的散在缺损,再到多节段灌注不匹配的缺损(6,7,16,31,42,44,62)。一个特殊病例表现为“节段轮廓模式”,它描绘出了没有灌注缺损的支气管肺段(55)。对PVOD患者来说通气-灌注扫描是非特异性的,当结果被解读为“高度可能”时,可能导致对慢性血栓栓塞性疾病的误诊(1,6,7,28,49)。
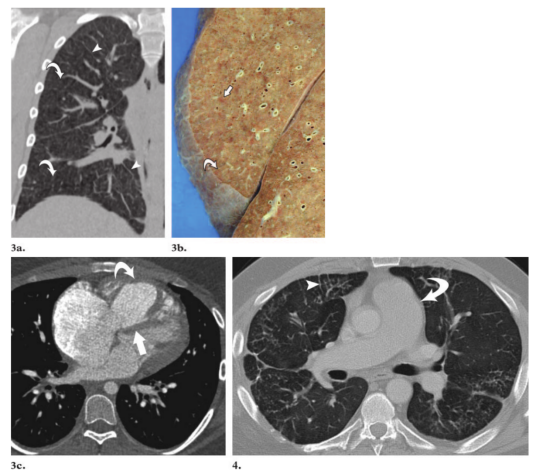
图3。PVOD,17岁女孩 (a)冠状面重构CT扫描(肺窗水平)显示广泛的小叶间隔线(箭头状)和弥漫的毛玻璃密度结节(箭)(b)右肺冠状面切面显示小叶间隔增厚(弯箭头)和边界不清的红棕色实质结节(直箭头)。(c)轴位CT图像(纵隔窗水平)显示右心室前壁增厚(弯箭头)。室间隔(直箭头)变直,右心房扩张,符合肺心病。图4。PVOD,43岁男性。轴位CT扫描(肺窗水平)显示多条小叶间隔增厚(箭头)和扩张的肺动脉主干(箭)。
PCH胸片显示PAH(肺动脉主干增宽和心脏右缘突出),并伴有弥漫性或双肺基底部的网状结节或微结节状不透明区域,不具有PVOD的特征(图5a, 5b)。与PVOD相比,小叶间隔增厚或胸腔积液不常见(13 - 15,40,45,61,63 - 66)(图5c, 6a)。纵隔淋巴结肿大在胸片上偶有报道(14,64)。PCH在CT上主要表现为肺动脉增宽和广泛分布的边界不清的小叶中心性毛玻璃密度影,常与小叶毛玻璃密度影混合(13,15,586,65 - 67)(图5c, 6a)。左心房轮廓正常或较小。小叶间隔增厚,淋巴结肿大,胸腔积液,右心室增大和心包积液偶有报道(15,58,67)。PCH患者的肺动脉造影通常正常,偶有肺栓塞或“非特异性血管异常”(15)。与PVOD一样,通气-灌注扫描对PCH的诊断没有帮助。其结果表现广泛,包括正常、小的灌注不匹配缺损(被认为“低度可能”)、明显的灌注不匹配缺损以至于可以被认为“高度可能”、多个匹配的缺损和双基底部动脉灌注弥漫性增加(13 - 15,19,63,65)。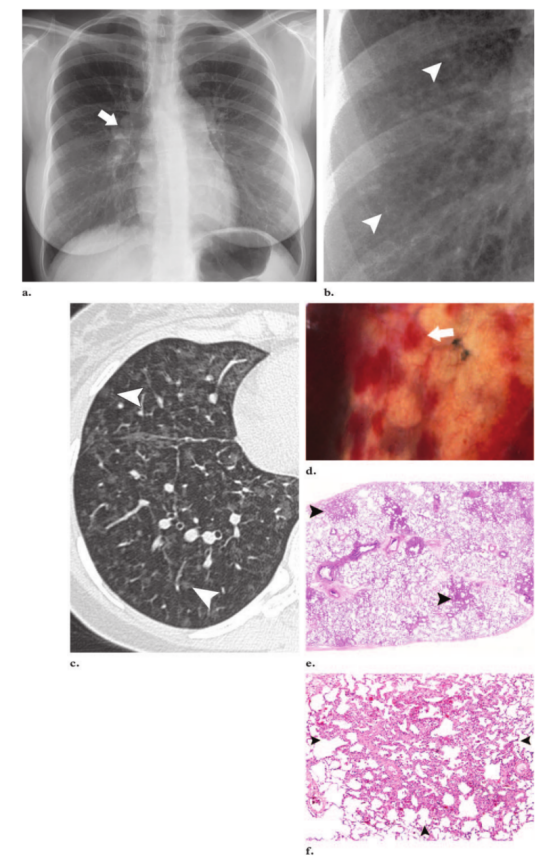
图5。PCH,22岁女性。(a)后前位胸片肺动脉中央区增粗(箭头)和基底部明显的微结节。(b)右肺下叶可见广泛的、边界不清的结节影。(c)右肺下叶轴位CT图像(肺窗水平)显示边界清晰的毛玻璃密度结节(箭头),无小叶间隔增厚。(d)脏层胸膜表面照片显示胸膜下可见多个瘀点状结节(箭头),这实际上代表了PCH的血管瘤性病变。(e)低倍显微照片(原始放大倍数,×1;苏木精-伊红[H-E]染色)显示多个散在的实质结节(箭头)。(f)低倍显微照片(原始放大倍数,×4;H-E染色)显示紧邻脏层胸膜的一个散在的实质结节(箭头)。
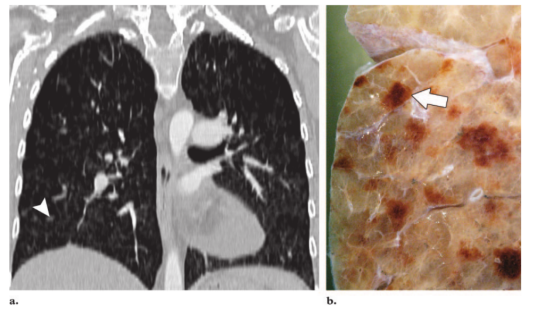
图6。PCH,27岁女性 (a)冠状面重构CT扫描(肺窗)显示弥漫性、边界不清的毛玻璃密度结节(箭头),未见小叶间隔增厚。(b)肺冠状切面照片显示多发出血性实质结节(箭)。
PVOD的组织学特征是内膜纤维化,其导致肺静脉狭窄和闭塞(3,5,52,68)。从大的小叶间静脉到毛细血管后微静脉,各种大小的肺静脉,都可能受累。大量的静脉可能受累,而且这个过程是不同步的,因此可以观察到肺静脉从正常到闭塞的整个谱系。使肺静脉狭窄和闭塞的内膜纤维组织从疏松、水肿、低细胞性(图7a)到致密、富含胶原性有不同的形式(图7b)。内膜纤维化再通是常见的,导致血管内间隔分隔的通道形成(图7a)。
PVOD的静脉病变伴有小叶间隔、肺实质和肺动脉的各种变化。小叶间隔是典型的水肿,包含扩张的淋巴管腔(图8a)。邻近小叶间隔处可发生包含病变静脉的梗死(所谓静脉性梗死)。狭窄和闭塞静脉的上游,肺实质内可见斑片状肺泡毛细血管扩张(图8b)。这些区域,因继发于慢性淤血,经常出现间质纤维化、出血和肺泡内出现含铁血黄素细胞(64)。血管和间质弹性纤维可能被铁包裹(所谓的内源性尘肺病),导致原位纤维化和肉芽肿巨细胞反应。继发于毛细血管引流后的静脉阻塞(10),肺实质内的小动脉出现肌化(图8c),而肌性肺动脉显示内侧肥厚(图8d)。值得注意的是,肌化的小动脉形态上呈圆形,这有助于在组织学上与小静脉较松弛的形态相区别。
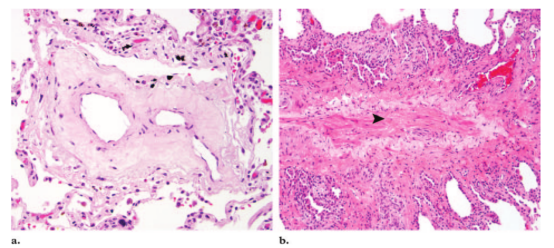
图7。PVOD的显微特征(a)中倍显微照片(原始放大,×20;H-E染色)显示薄壁的静脉管腔因为疏松、水肿的内膜纤维增生而狭窄,并因出现血管再通而形成三个通道。(b)中倍镜(原始放大倍数为,×10;H-E染色)显示纤维化的小叶间隔内有静脉,其管腔被致密的富含胶原的纤维组织阻塞(箭头)。
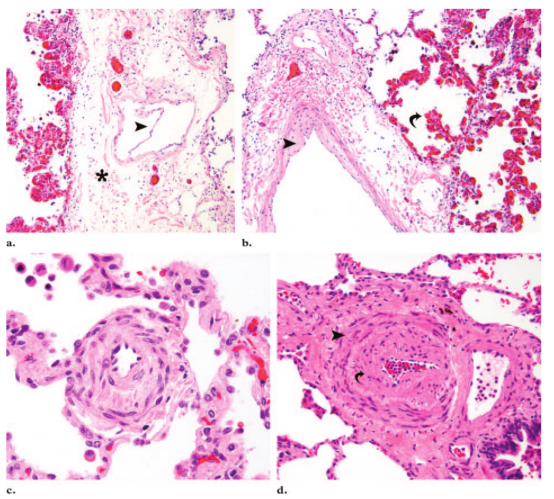
图8。PVOD的显微特征(a)中倍显微照片(原始放大倍数,×10;H-E染色)显示水肿的小叶间隔(*),内有扩张的淋巴管,淋巴管可见瓣膜(箭头所指)。(b)中倍镜(原始放大倍数为×10;H-E染色)显示狭窄的静脉(箭头)上游的袢状肺泡毛细血管扩张(箭)。(c)高倍显微照片(原始放大倍数,×40倍;H-E染色)显示肌化的小动脉,由同心圆排列的梭形平滑肌细胞组成,使血管呈明显的圆形结构,一般来说,小动脉缺乏平滑肌;(d)中倍显微镜(原始放大,×20;H-E染色)显示肌性肺动脉内壁肥厚(箭头),本例中也可见内膜增厚(箭)。
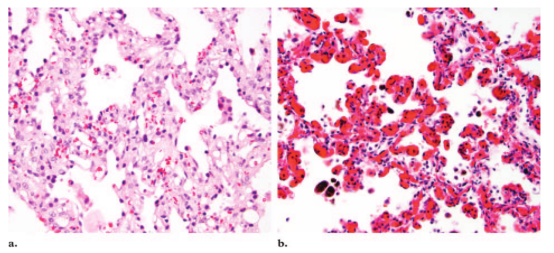
图9。PCH的显微特征(a)中倍显微照片(原始放大,×20;H-E染色)显示PCH毛细血管增生导致肺泡壁增厚和细胞密集性表现。(b)相比之下,中倍镜(原始放大倍数为×20;H-E染色)显示PVOD毛细血管呈袢样扩张。
PCH最显著的组织学特征是肺泡壁内毛细血管增生(12,40,63,64,67,69)。当使用扫描放大时,PCH显示边界清晰的肺实质病变,病变间的肺组织相对不明显(图5e)。早期病变显示沿肺泡壁有几排毛细血管;晚期病变这一特征进展为结节和背靠背的大片毛细血管(64)。这些增殖性改变导致了肺泡壁出现细胞密集性的组织学表现,而PVOD则是毛细血管呈袢样扩张PVOD(图9):无细胞异型性和有丝分裂。增殖的毛细血管包围并压迫肺小静脉和静脉网的血管壁,导致内膜纤维化和继发性静脉闭塞(64)。与PVOD一样,这些特征导致小动脉代偿性肌化和肌性肺动脉内壁肥厚(67)。在不明原因的PAH中,PVOD和PCH的临床和影像学诊断非常困难,组织学检查被认为是确定诊断的最可靠手段。典型的PVOD表现为阻塞的静脉病变伴小叶间隔水肿、毛细血管床袢状扩张和继发的动脉改变(图10a, 10b)。典型的PCH表现为边界清晰的增生性毛细血管病变,及继发性动脉改变(图10c)。因为PVOD与PCH的组织学相似,PCH在病理上容易被误诊为PVOD,而PVOD却很少被误诊为PCH。例如,很难区分袢状毛细血管扩张和毛细血管增生。而网状纤维和弹性纤维的特殊染色(如使用网硬蛋白染色、Movat五色套染或Verhoeff-van Gieson 染色)可以显示PVOD中肺泡上皮层之间单个扩张的毛细血管形成的袢状病变与PCH中使肺泡壁增厚的增生毛细血管之间的差异。第二个组织学陷阱是,PVOD的肺动脉改变可能非常明显,因此被误诊为PAH或PCH。最后,活检材料不足,特别是没有小叶间隔的标本,也可能导致PVOD或PCH的漏诊。据建议,外科肺活检标本至少包含五个次级肺小叶结构,才能充分评估肺血管病变(70)。
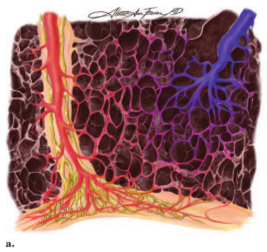
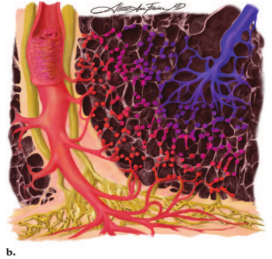
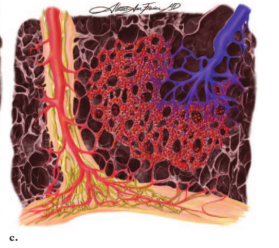
图10。次级肺小叶和小叶间隔水平的显微解剖图示。(a)正常血流动力学情况下,肺小叶中心性肺动脉(蓝色)进入肺泡壁内的毛细血管网,充氧的血液随后流入小叶间隔静脉(红色)。胸膜和小叶间隔内均可见淋巴网(黄色)。(b) PVOD中小叶间隔静脉闭塞,毛细血管网继发扩张,形成多血管袢,淋巴管充血,小叶间隔水肿。(c) PCH有离散的毛细血管增生区,而肺静脉或小叶间隔没有明显变化。
对于PVOD和PCH尚缺乏经过RCT研究检验安全性和有效性的药物;大多数关于治疗的数据只存在于病例报告中(1,6,71,72)。肺或心肺移植是唯一可治愈的治疗选择;药物治疗仅作为支持治疗和移植前的桥梁作用(1,6,13 - 15,73 - 75)。临床医生使用常规药物治疗,来降低肺血管阻力,增加心输出量,减少容量过负荷,包括利尿剂、抗胆碱酯酶(ACE)抑制剂、抗凝剂(华法林)、强心苷(地高辛)和氧疗(1,15)。其他使用的药物包括肺血管扩张剂(钙通道阻滞剂,前列环素)和免疫抑制剂(糖皮质激素)(1)。试验性治疗包括α-干扰素和血管生成抑制剂(15,72,75,76)。虽然以上许多药物在治疗PPH中的作用有科学数据的支持,但它们在治疗PVOD或PCH中的益处仍存在疑问(15,19,75,77)。PAH中使用的一种选择性肺血管扩张药物,口服西地那非(一种磷酸二酯酶-5抑制剂),已被证明可以改善一些PVOD患者的血流动力学和临床病程(78,79)。然而,在许多情况下,临床经验表明,强效的血管扩张剂(包括持续静脉注射前列环素和钙通道阻滞剂)在PVOD或PCH患者中会诱发严重甚至致命的肺水肿。这种有害结果的解释如下:如果肺肌性动脉和小动脉扩张,而肺静脉阻力保持不变,增加的毛细血管静水压力将导致大量液体渗出到肺实质(15,19,58,75,80)。放射科医生在这种情况下扮演着重要的角色:为了排除PVOD或PCH在影像学上的可能,目前建议假定为PPH的患者在血管扩张剂治疗开始前需要接受HRCT检查(75,81)。不幸的是,接受器官移植的平均时间往往超过PVOD和PCH患者的预期寿命(1)。一名接受单肺移植的PVOD患者,术后3个月的HRCT显示先前扩张的右心室恢复正常,原生肺的毛玻璃密度影和小叶间隔线几乎完全消失(56)。通气-灌注扫描显示移植肺灌注达80%,这一发现提示PVOD的放射学改变至少部分与血流动力学异常有关,而不是固定的解剖学异常(56)。另一个病例报告描述了一例心肺移植术后3个月复发的PVOD,该病例的诊断是基于临床和放射学特征,没有进行肺活检证实(82)。11例来自AFIP的病例,包括PVOD (n=7)和PCH (n=4)由2名放射学家(A.A.F., J.R.G.)和2名病理学家(T.J.F.,I.H.O.)进行评估(表)。PVOD患者年龄17 ~ 56岁(平均38岁),男女比例为2:5。PCH患者年龄12-52岁(平均28岁),男女比例为1:3。只有3例PVOD患者的胸片资料,3例均有肺动脉干突出,2例有Kerley B线,3例有胸腔积液。一个PCH病例中,胸片显示主肺动脉干突出和广泛的、亚厘米大小的肺结节。大多数PVOD患者(6 / 7)和一半PCH患者(2 / 4)显示了与肺动脉高压相一致的令人印象深刻的CT表现,包括主肺动脉扩张(直径>3cm)、右心腔扩大、静脉造影剂回流至下腔静脉或心包积液。7例PVOD(肺窗)均表现为小叶间隔光滑增厚,3例为少量小叶间隔,4例为大量小叶间隔。4例PCH患者的CT扫描均显示小叶间隔光滑增厚,增厚的小叶间隔均匀稀疏,数量较少。所有PVOD和PCH病例均可见地图状或结节状毛玻璃密度阴影,且以弥漫性分布为主。结节状毛玻璃密度影表现为界限不清(4例PCH中2例;7例PVOD中的3例)或边界清晰(4例PCH中的2例)。地图状毛玻璃密度影在PVOD 7例中有4例,而PCH病例中未见。7例PVOD病例中有3例发现胸腔积液,只有1例出现淋巴结肿大。2例病例影像学上基于毛玻璃密度结节的表现错误诊断为PCH,而病理组织学检查最终确诊为PVOD。
PVOD和PCH在临床上与原发性PAH疾病如PPH或慢性血栓栓塞性肺动脉高压难以区分。然而,这一区别对于适当的药物干预以及对肺移植的及时评估至关重要。事实上,如果一个患有PVOD或PCH的患者被推定为PPH,使用标准的血管扩张剂(如连续静脉注射前列环素或钙通道阻滞剂)治疗,可能会导致严重的、可能致命的肺水肿。放射科医生可能是第一个发现未被怀疑的毛细血管或毛细血管后病变的人,否则这些病变会被令人印象深刻的PAH的临床表现所掩盖,HRCT目前被推荐为这些患者的最佳影像学评估手段。可以帮助区分PVOD和PCH与PAH的影像学表现包括光滑的小叶间隔线、地图样或结节性毛玻璃密度影和胸腔积液。毛细血管前病变如PPH和慢性血栓栓塞性肺动脉高压并不会导致小叶间隔增厚,而增厚是由毛细血管或毛细血管后循环压力升高引起的。PPH可导致肺外周血量减少,慢性血栓栓塞性肺动脉高压可出现马赛克肺衰减和血管修剪,但均不表现为小叶间隔线。以光滑的小叶间隔增厚和毛玻璃密度影为特征的疾病包括纵隔纤维化(肺静脉受压,导致引流受阻)、左心房粘液瘤、三房心、二尖瓣狭窄和左心室衰竭(48,49,57 - 60)。然而,在这些情况下,CT可显示肺静脉扩张以及其他显著特征,如纵隔钙化、二尖瓣钙化、左房充盈缺损或左室增大。在我们对11例来自AFIP的PVOD和PCH的病例回顾中,我们进一步寻找任何可能使PVOD与PCH区分开的影像学特征。但是PVOD与PCH的CT表现广泛重叠,因此在出现PAH特征并伴有小叶间隔线、毛玻璃密度影和偶有胸腔积液的表现的鉴别诊断中,PVOD和PCH都应该被提及。虽然PVOD和PCH中都存在小叶间隔线,但我们发现更多的间隔线(相对于较少的情况)更强烈提示PVOD的诊断,而非PCH。此外,如果有毛玻璃密度结节且边界清楚,特别是在小叶间隔线稀少或不存在时,建议诊断为PCH而不是PVOD。 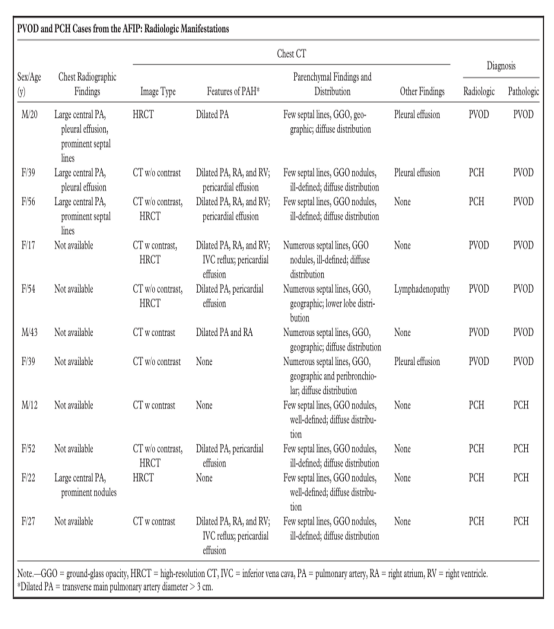
参考文献:(略)
图文编辑:刘宏宇