
患者52岁,男,BMI 23.6,主因“咳嗽、咳痰、发热20余天”来诊。
现病史:20余天前(2024-6-1)无明显诱因出现咳嗽、咳痰,痰少,色白,伴发热,最高体温39℃,多在下午或者晚上,可自行缓解或者口服布洛芬可退烧,但症状反复。外院化验(2024-6-5):白细胞18.96×109mmol/L,中性粒细胞14.09×109mmol/L,淋巴细胞3.56×109mmol/L,血小板513×109mmol/L,血红蛋白98g/L,CRP 130.86 mg/L。铁蛋白846 ug/L,PCT<0.1ng/mL。尿常规未见异常。核抗体谱及血管炎抗体谱(-)、类风湿因子3340IU/ml。PPD强阳性伴水疱,T-SPOT阳性。隐球菌抗原(-)、GM实验(-)、G实验(-)。前列腺及肺癌肿瘤标志物正常。骨髓穿刺形态学检查未见异常。
胸部增强CT(2024-06-05):双上肺实变,颈部及纵隔淋巴结肿大。
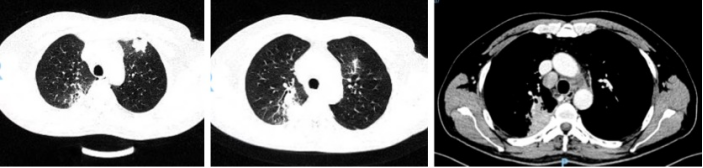
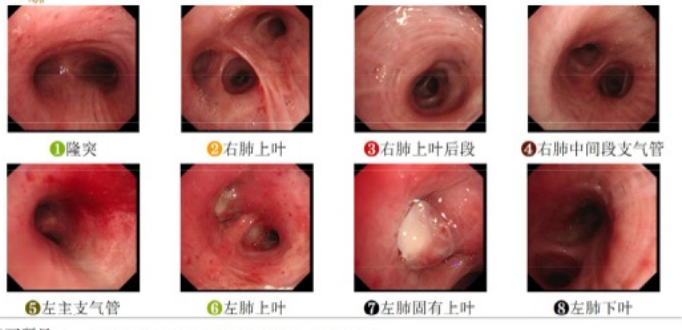
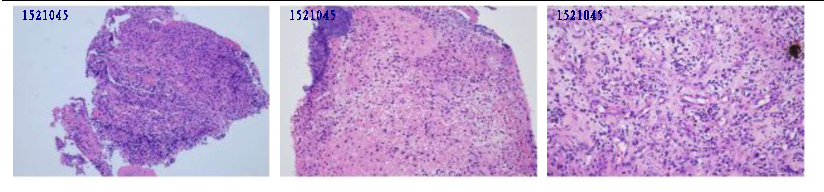
气管镜:左肺固有上叶黏膜肿胀,可疑新生物阻塞管腔;BALF培养:肺炎克雷伯菌,余均阴性;左固有上叶TBLB病理:炎性坏死及肉芽组织,抗酸染色阳性,结核分枝杆菌核酸阴性。

先后予利奈唑胺、奥玛环素、泰能、左氧氟沙星、头孢派酮舒巴坦(6.18-6.20)、替加环素抗感染。2024-06-11开始利福平、异烟肼、吡嗪酰胺、乙胺丁醇四联抗结核治疗,患者仍反复咳嗽、咳痰、发热,热峰较前稍下降(由39-40℃降至38-39℃)。起病以来体重减轻10余公斤。
既往史:既往体健,1年前曾患肺炎,抗感染治疗后缓解。
个人史、婚育史及家族史:无特殊

患者中年男性,亚急性病程。以发热、咳嗽、咳痰为主要症状。既往体健,近1年反复感染,伴全身淋巴结肿大。白细胞及中性粒细胞显著升高,CT示肺部渗出影,BALF培养肺炎克雷伯菌、肺组织抗酸阳性,抗感染治疗效果欠佳。查体左侧颈部淋巴结肿大。
诊断思路:
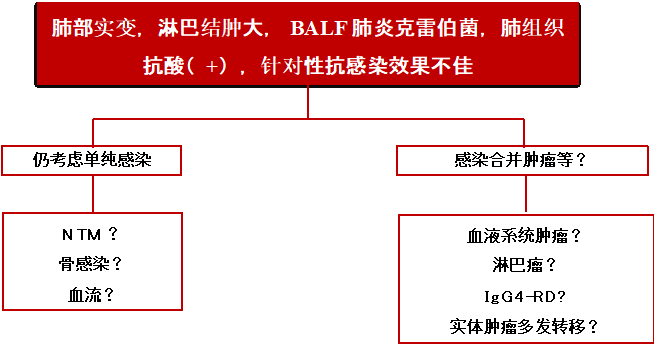
入院进一步检查:
尿液及血浆的免疫固定电泳:正常;
免疫球蛋白+补体:IgG 2130↑mg/dl, IgM 277.0↑mg/dl,其余指标正常, IgG4 (-)
浅表淋巴结:左侧颈部II区淋巴结增大,结构异常;右侧腹股沟区淋巴结增大
血感染相关:结核感染T细胞检测阴性;EB病毒核酸检测阴性;G试验、GM试验、曲霉IgG抗体阴性;布氏杆菌凝集试验阴性;
痰病原:细菌培养肺炎克雷伯菌阳性;分支杆菌培养鸟胞内分枝杆菌阳性
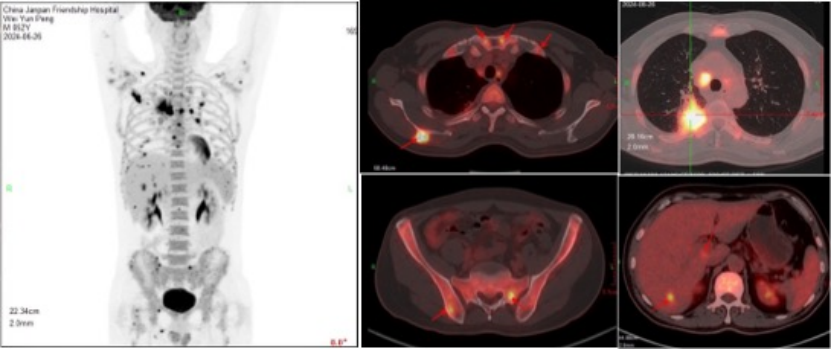
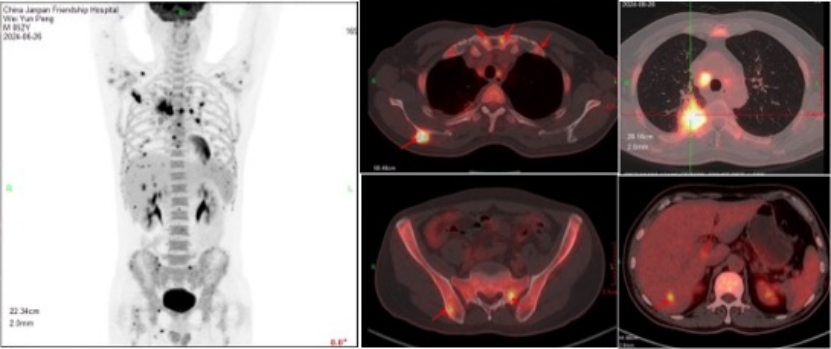
PET-CT检查:
1.双肺上叶病变呈高代谢,全身多发淋巴结不同程度代谢增加,肝、脾及多骨高代谢灶,建议右肺上叶病灶穿刺活检,除外恶性肿瘤性病变。
2.脾及骨髓弥漫代谢增加,考虑炎性继发改变。双肺内微小结节及双侧叶间胸膜结节样增厚,未见代谢增加,考虑良性可能;右肺下叶少许炎性病变;双肺气肿。心包少量积液。
3.脂肪肝。前列腺内多发钙化。右肩关节周围炎。
右侧肩胛骨CT引导下穿刺活检:髓腔内淋巴细胞、浆细胞、组织细胞及中性粒细胞增多,细胞形态成熟,未见上皮样肉芽肿及坏死,未见恶性肿瘤;特殊染色查见少数抗酸染色阳性杆菌。免疫组化结果:CD20(L26)(少数+)、CD3(较多+)、KP-1(较多+)、CD138(较多+)、Ki67(MIB-1)(约30%+)、MPO(+)、Cyclin D1(个别+)。特殊染色结果:抗酸(+)。分子病理:鸟胞内分支杆菌
诊断:全身播散性NTM感染(肺、淋巴结、骨、肝等);肺炎克雷伯菌肺炎
治疗方案:
派拉西林他唑巴坦 4.5g q8h
阿奇霉素 0.5 g qd
利福平 0.3 g qd
乙胺丁醇 0.75 g qd
异烟肼 0.45 g qd


患者外周血淋巴细胞亚群:CD4+T 1914 cells/uL (395-1264), CD8+T 936 cells/uL (270-1059), CD19+B 220 cells/uL (92-498);免疫球蛋白+补体:IgG 2130↑mg/dl,IgM 277.0↑mg/dl,其余指标正常,IgG4 (-);抗γ-IFN抗体167.76ng/mL(0-54)。
因此考虑患者存在抗γ-IFN抗体造成的成年出现的免疫缺陷(Adult-Onset Immunodeficiency)可能。
抗γ-干扰素自身抗体(Anti-IFN-γ Autoantibodies, AIGAs)相关性免疫缺陷病是一种由中和性自身抗体介导的获得性免疫缺陷综合征,多见于成人,以Th1细胞免疫功能受损为核心特征。患者因反复发生播散性感染(如分枝杆菌、真菌、病毒等),且常规免疫抑制治疗反应有限,逐渐成为临床关注的罕见免疫性疾病。近年来,随着检测技术进步,全球病例报道逐渐增多,但其发病机制及标准化治疗方案仍需深入探索。
从病因与发病机制来看,AIGAs的产生是疾病的核心触发因素。患者体内存在针对IFN-γ的中和性IgG抗体,这类抗体通过与IFN-γ受体结合,阻断其与受体的相互作用,进而抑制下游信号传导。IFN-γ作为Th1细胞介导抗胞内菌感染的关键细胞因子,其功能受损会导致IL-12/IFN-γ轴中断,巨噬细胞无法有效激活,IL-12、TNF-α等免疫调节因子分泌减少,最终形成“免疫逃逸”微环境,使病原体得以在体内播散。此外,免疫调节失衡还表现为体液免疫的代偿性激活:部分患者出现免疫球蛋白(IgG、IgE)升高及嗜酸性粒细胞增多,可能与B细胞功能异常或Th2型免疫应答偏移有关。
临床表现方面,AIGAs相关性免疫缺陷病的核心特征是反复发生的机会性感染,且感染谱具有显著特异性。真菌感染中,马尔尼菲篮状菌是最常见的病原体,表现为播散性感染伴淋巴结肿大、皮肤溃疡。分枝杆菌感染以非结核分枝杆菌(NTM)和结核分枝杆菌为主,常累及肺部、淋巴结(无痛性肿大)及骨骼。病毒感染以带状疱疹、巨细胞病毒再激活为典型,表现为皮肤疱疹、发热及多器官受累。除感染外,患者常伴随全身症状,如长期不规则发热、慢性咳嗽;体格检查可见颈部、腋窝等多部位淋巴结肿大。
诊断AIGAs相关性免疫缺陷病需结合临床表现、实验室检测及病原学证据。实验室检测中,抗IFN-γ抗体的检测是关键——通过ELISA等可测定血清抗体滴度。免疫功能评估包括T细胞亚群分析(Th/Ts比值异常)及细胞因子水平检测(IL-12、TNF-α降低),可进一步确认Th1免疫功能受损。影像学检查(CT/MRI)常显示多发性淋巴结肿大、肺部浸润影或骨质破坏,为感染定位提供依据。病原学确诊则依赖宏基因组测序(mNGS)或病原体培养,例如马尔尼菲篮状菌可通过血培养或组织病理学检查(酵母相)明确,NTM需通过分枝杆菌培养或PCR检测。
治疗策略需兼顾抗感染与免疫调节,且需个体化制定。抗感染治疗是基础。免疫调节治疗旨在减少AIGAs产生或阻断其效应,免疫球蛋白替代治疗(IVIG)可补充外源性IgG,增强机体抗感染能力,但目前缺乏临床数据支持。预后方面,早期诊断并及时控制感染可显著改善生存率,但疾病易复发,需长期随访监测感染活动及抗体滴度变化。
综上,抗γ-干扰素自身抗体相关性免疫缺陷病以反复播散性感染为核心特征,其诊断依赖抗IFN-γ抗体检测与病原学分析,治疗需多学科协作兼顾抗感染与免疫调节。未来随着发病机制研究的深入及新型疗法的开发,该病的精准管理有望得到显著提升。
参考文献:
1. Browne SK, Burbelo PD, Chetchotisakd P, Suputtamongkol Y, Kiertiburanakul S, Shaw PA, Kirk JL, Jutivorakool K, Zaman R, Ding L, Hsu AP, Patel SY, Olivier KN, Lulitanond V, Mootsikapun P, Anunnatsiri S, Angkasekwinai N, Sathapatayavongs B, Hsueh PR, Shieh CC, Brown MR, Thongnoppakhun W, Claypool R, Sampaio EP, Thepthai C, Waywa D, Dacombe C, Reizes Y, Zelazny AM, Saleeb P, Rosen LB, Mo A, Iadarola M, Holland SM. Adult-onset immunodeficiency in Thailand and Taiwan. N Engl J Med. 2012 Aug 23;367(8):725-34.
2. Guo J, Ning XQ, Ding JY, Zheng YQ, Shi NN, Wu FY, Lin YK, Shih HP, Ting HT, Liang G, Lu XC, Kong JL, Wang K, Lu YB, Fu YJ, Hu R, Li TM, Pan KS, Li XY, Huang CY, Lo YF, Chang IY, Yeh CF, Tu KH, Tsai YH, Ku CL, Cao CW. Anti-IFN-γ autoantibodies underlie disseminated Talaromyces marneffei infections. J Exp Med. 2020 Dec 7;217(12):e20190502.
3. Hong GH, Ortega-Villa AM, Hunsberger S, Chetchotisakd P, Anunnatsiri S, Mootsikapun P, Rosen LB, Zerbe CS, Holland SM. Natural History and Evolution of Anti-Interferon-γ Autoantibody-Associated Immunodeficiency Syndrome in Thailand and the United States. Clin Infect Dis. 2020 Jun 24;71(1):53-62.



