摘要
免疫抑制宿主新型冠状病毒(SARS-CoV-2)感染所致肺炎表现较健康人有所不同。本文报道一例既往滤泡性淋巴瘤经CD20单抗治疗后B细胞清除患者,自2022年12月感染SARS-CoV-2后出现反复发热、咳嗽、咳痰伴双肺多发游走性磨玻璃影,在2023年3月诊断为SARS-CoV-2感染致肺炎,给予奈玛特韦/利托那韦单药治疗15 d后症状缓解,双肺多发磨玻璃影吸收,且未反复。综合考虑患者病情可能为SARS-CoV-2“持续”或“迁延”感染导致。
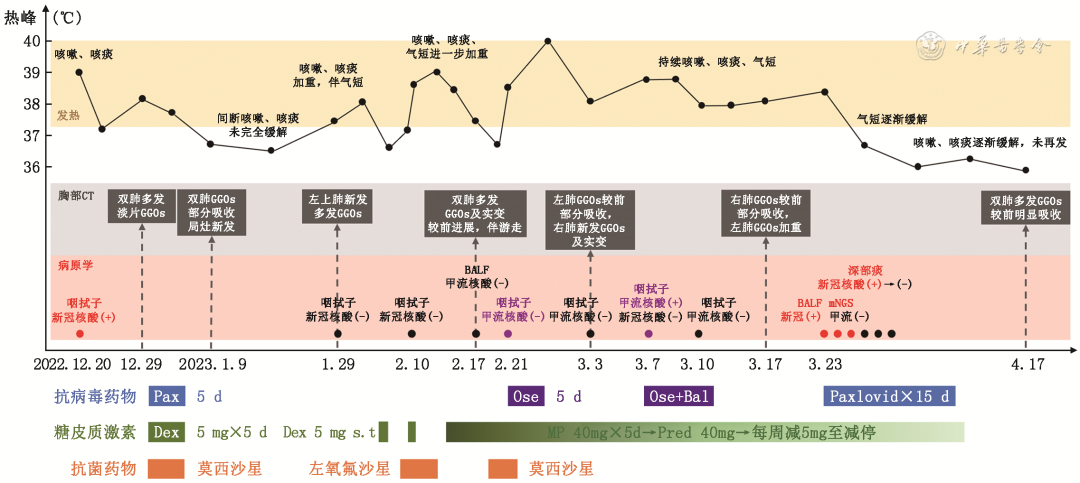
患者男,58岁,主因“间断发热、咳嗽3个月,加重伴气短1个月”于2023年3月7日入院。患者3个月前(2022年12月20日)接触新型冠状病毒(SARS-CoV-2)感染者后出现发热,体温最高达39.0 ℃、伴咳嗽、咳痰,测咽拭子SARS-CoV-2核酸阳性,2022年12月29日仍有发热,胸部CT示双下肺多发小片磨玻璃影(GGO)(图1),于外院给予奈玛特韦/利托那韦(Paxlovid,3片/次,1次/12 h,口服5 d)抗病毒、地塞米松(5 mg,1次/d,静脉滴注5 d)抗炎治疗,发热症状缓解。2023年1月9日复查胸部CT提示双肺多发GGO较前部分吸收,局灶有新发病变(图2)。
患者仍有间断咳嗽、咳痰,2023年1月29日再次出现发热,最高体温37.5 ℃,伴咳嗽、咳痰加重、活动后气短,复查胸部CT示左上肺新发淡片GGO(图3),测咽拭子SARS-CoV-2核酸阴性。外院间断给予左氧氟沙星、莫西沙星及地塞米松治疗(剂量不详),患者症状未缓解,活动后气短逐渐加重,于2023年2月10日第一次入院。
既往11月前(2022-04)因双侧颈部淋巴结肿大就诊于外院,行PET/CT检查及淋巴结穿刺活检诊断为滤泡性淋巴瘤IVA期,应用G-CHOP方案(奥妥珠单抗1000 mg d1,8,15+环磷酰胺1.44g d2+表柔比星135 mg d2+长春新碱2 mg d2+泼尼松100 mg d2-6,q21d)化疗,2周期后出现呼吸衰竭,胸部CT提示双肺弥漫磨玻璃影,外院诊断为“药物相关肺损伤”并予糖皮质激素治疗后缓解,后仅应用CHOP方案完成诱导治疗,2022年11月3日开始单药奥妥珠单抗维持。
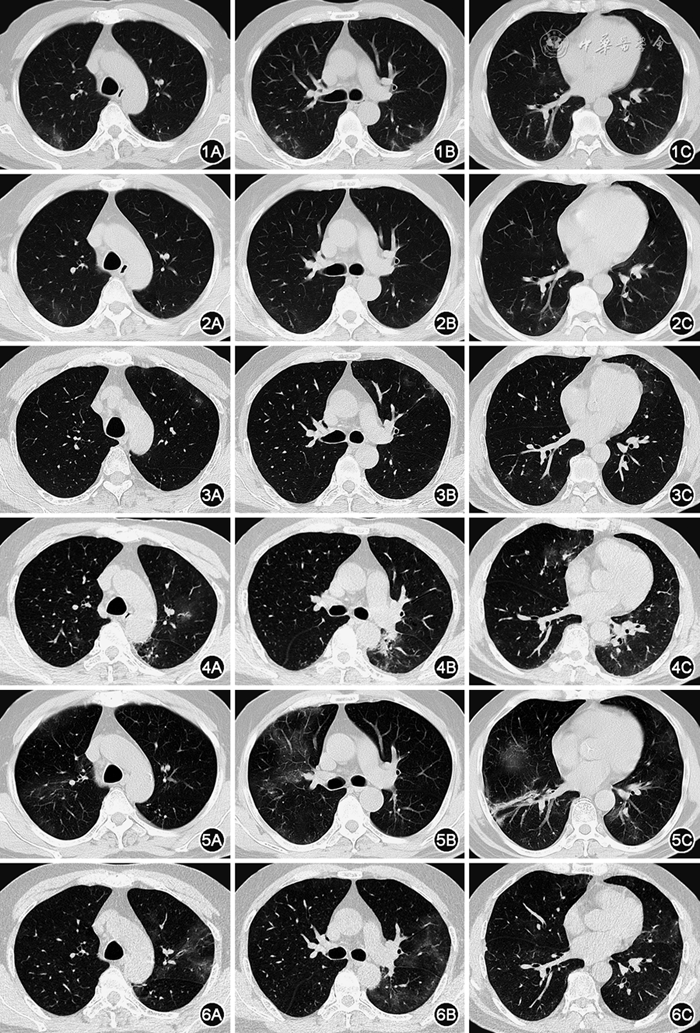
图1 患者感染SARS-CoV-2后,持续发热,2022-12-29查胸部CT提示双下肺多发磨玻璃影(GGO)
图2 经过初始治疗后,2023年1月9日患者查胸部CT提示双肺多发GGO部分吸收,但有局灶新发
图3 2023年1月29日患者再次发热,伴咳嗽、咳痰加重及活动后气短,复查胸部CT提示左上肺新发多发GGO
图4 患者仍反复发热,2023年2月17日复查胸部CT提示双肺新发多发GGO及实变影,整体较前进展,部分(左上肺)病灶呈游走性特征
图5 患者感染甲型流感病毒,经抗病毒治疗后仍有发热,2023年3月3日复查胸部CT提示左肺多发GGO较前部分吸收,右肺新发多发GGO及实变
图6 患者再次加强抗甲型流感病毒治疗后,仍反复发热,2023年3月17日复查胸部CT提示右肺GGO较前部分吸收,左肺多发GGO较前加重
体检:体温38.3 ℃,脉率100次/min,呼吸频率30次/min,血压:116/69 mmHg(1 mmHg=0.133 kPa)。全身浅表淋巴结未触及肿大,双肺呼吸音粗,心脏、腹部查体无殊。
实验室检查:动脉血气分析(FiO2为21%):pH值7.48,PaCO2为33 mmHg,PaO2为79 mmHg,HCO3-为24.6 mmol/L。血常规提示白细胞正常,淋巴细胞0.78×109/L↓,C反应蛋白(CRP)55.25 mg/L(正常参考值≤10 mg/L);抗核抗体及抗中性粒细胞胞质抗体(ANCA)阴性;测咽拭子SARS-CoV-2核酸阴性;支气管镜检查BALF细胞分类计数示淋巴细胞百分比66.5%(正常参考值:7%±1%),中性粒细胞百分比1.5%(正常参考值:<1%),BALF细菌涂片染色及培养、真菌涂片染色及培养、抗酸染色、MTB/RIF-Xpert、分枝杆菌液体培养、肺炎支原体、肺炎衣原体、甲型/乙型流感病毒、呼吸道合胞病毒、腺病毒核酸均阴性,BALF未测SARS-CoV-2核酸。
患者在院期间仍反复发热,2023年2月17日复查胸部CT提示左上叶GGO较前进展,右中叶及左下叶新发GGO及实变影,左上肺GGO有游走性特征(图4)。结合既往史,诊断“药物相关肺损伤”,给予甲泼尼龙(40 mg/d)静脉滴注5 d,患者体温降至正常。2023年2月21日患者接触甲型流感病毒感染者后再次出现发热,最高体温38.4 ℃,测咽拭子甲型流感病毒核酸阳性,给予奥司他韦(75 mg,1次/12 h)口服5 d后出院。出院后口服泼尼松(40 mg,1次/d),每周减量1片,但患者仍反复发热,最高体温 40.0 ℃,热型同前。2023年3月3日测咽拭子甲型流感病毒核酸阴性,复查胸部CT(当时口服泼尼松35 mg/d,1次/d)提示左肺多发GGO较前部分吸收,右肺新发多发GGO及实变(图5)。为进一步诊疗于2023年3月7日再次入院。
体检:体温38.0 ℃,脉率103次/min,呼吸频率24次/min,血压:102/67 mmHg。双肺呼吸音清,心脏、腹部体检无特殊。
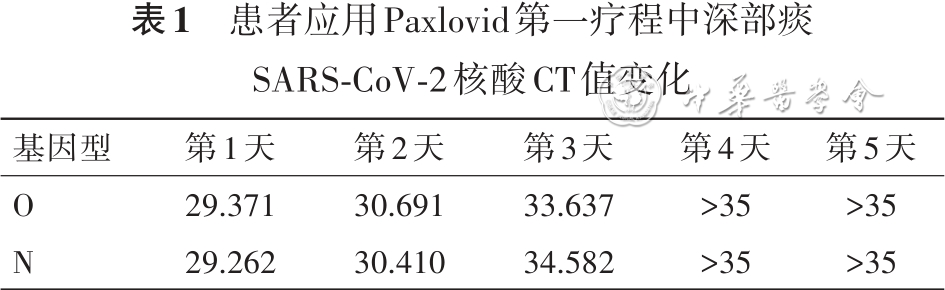
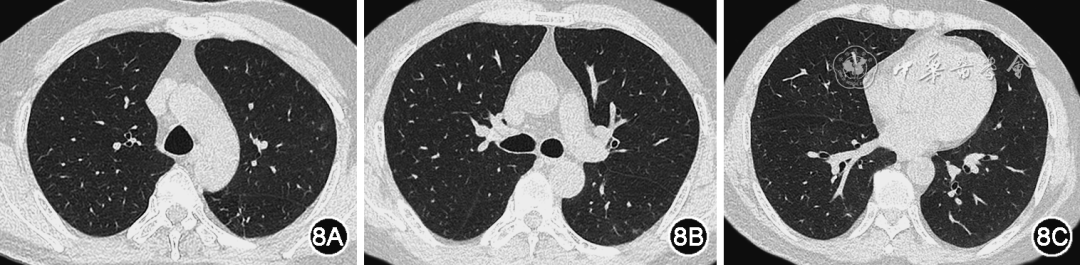
实验室检查:血常规示白细胞正常,淋巴细胞0.64×109/L,CRP为33.26 mg/L,PCT<0.20 μg/L;外周血G试验、GM试验均阴性;淋巴细胞亚群示CD3+T细胞 991个/μl(正常参考值:835~2 217个/μl),CD3+CD8+T细胞 493个/μl(正常参考值:270~1 059个/μl),CD3+CD4+T细胞 474/μl(正常参考值:395~1 264个/μl),NK细胞89个/μl(正常参考值:136~880个/μl),CD19+B细胞 0(正常参考值92~498);测咽拭子甲型流感病毒核酸阳性、SARS-CoV-2核酸阴性。给予奥司他韦(75 mg,1次/12 h,口服5 d)联合玛巴洛沙韦(40 mg,即刻口服2次,间隔72 h)治疗,同时泼尼松迅速减量。2023年3月10日复测咽拭子甲型流感病毒核酸阴性,但患者每日仍有发热。2023年3月14日复查胸部CT提示右肺GGO较前部分吸收,左肺GGO较前加重(图6)。为进一步明确反复发热及肺部病变病因,2023年3月23再次行支气管镜检查:BALF细胞分类计数提示淋巴细胞 77.0%,中性粒细胞1.5%;BALF病原学:细菌涂片及染色、真菌涂片及染色、抗酸染色、MTB/RIF-Xpert、甲型/乙型流感病毒、CMV、EBV、肺炎支原体、肺炎衣原体、腺病毒核酸均阴性。BALF宏基因组二代测序(metagenomics next generation sequencing,mNGS):SARS-CoV-2(奥密克戎BF.7.14)序列数21 802。经支气管冷冻肺活检(transbronchial lung cryobiopsy,TBLC)病理回报:送检肺组织呈慢性炎症,部分肺泡上皮增生,肺泡间隔稍宽,间质少量慢性炎症细胞、主要为淋巴细胞浸润,小血管周围略多,以T淋巴细胞为主(图7)。因患者咽拭子SARS-CoV-2核酸阴性,嘱患者咳深部痰测SARS-CoV-2核酸阳性(CT值:O基因 29.371,N基因 29.262),查SARS-CoV-2 IgM及IgG均阴性。综上考虑患者诊断病毒性肺炎、新型冠状病毒感染(中型)(coronavirus disease 2019,COVID-19)明确,给予Paxlovid(3片,1次/12 h)口服治疗,抗病毒治疗2 d后患者体温降至正常,3 d后测深部痰SARS-CoV-2核酸转阴,SARS-CoV-2核酸CT值变化见表1。回顾患者感染SARS-CoV-2以来病程,因应用CD20单克隆抗体后B细胞为0,确诊COVID-19后未检出SARS-CoV-2抗体,既往曾应用单疗程Paxlovid可能未实现病毒清除导致病情反复,故单疗程后继续应用Paxlovid抗病毒治疗,患者在应用第2疗程Paxlovid时仍有轻微呼吸道症状,应用第3疗程时发热、呼吸道症状基本完全缓解,故抗病毒3个疗程(15 d)后停药,泼尼松逐渐减停。2023年4月17日患者复查胸部可见双肺GGO病变较前明显吸收(图8),后续随访患者无发热、咳嗽、咳痰、活动后气短症状反复。患者起病来病情变化主要特征、病原学及治疗概览见图9。
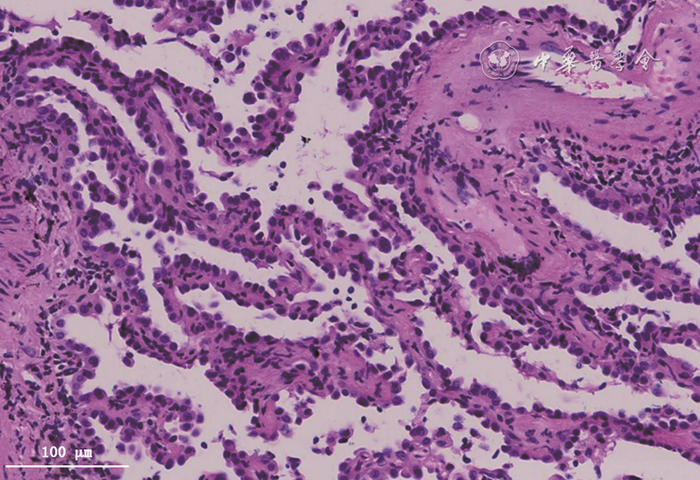
图7 经支气管镜冷冻肺活检组织HE染色可见局灶肺泡间隔略增宽,肺泡上皮细胞显著增生 高倍放大
图8 患者经3个疗程Paxlovid治疗后,2023年4月17日复查胸部CT提示双肺多发GGO较前明显吸收
图9 患者起病以来病情变化主要特征、病原学及治疗概览。Bal:玛巴洛沙韦;Dex:地塞米松;GGO:磨玻璃影;MP:甲泼尼龙;Ose:奥司他韦;Pax:Paxlovid(奈玛特韦/利托那韦);Pred:泼尼松;新冠:新型冠状病毒(SARS-CoV-2);甲流:甲型流感病毒
讨论
王诗尧(呼吸与危重症医学科):本例特点:(1)中年男性,慢性病程,以反复发热(弛张热)、咳嗽、咳痰、活动后气短为主要表现;(2)既往滤泡性淋巴瘤Ⅳ期、G-CHOP方案化疗后,期间有“药物相关肺损伤”病史;(3)体格检查除发热未见明显异常;(4)胸部影像学表现为双肺多发、游走性GGO及小片实变影;(5)实验室检查提示外周血淋巴细胞绝对值减低,CRP升高,B细胞(CD19+B细胞)计数为0,SARS-CoV-2 IgM、IgG均阴性;(6)深部痰SARS-CoV-2核酸阳性;(7)BALF细胞分类计数提示淋巴细胞比例异常升高,BALF mNGS提示SARS-CoV-2阳性,TBLC提示肺泡上皮增生,肺泡间隔稍宽,间质少量慢性炎细胞浸润;(8)病程中合并甲型流感病毒感染(有接触史,咽拭子甲型流感病毒核酸阳性),两次应用抗甲型流感病毒治疗后咽拭子核酸转阴,但转阴后患者症状缓解不明显。
患者病情较为复杂,主要表现为发热、呼吸道症状伴双肺多发GGO,BALF mNGS提示高序列数SARS-CoV-2,深部痰标本SARS-CoV-2核酸亦阳性,可以一元论解释患者临床及影像表现,故SARS-CoV-2病毒性肺炎诊断明确。但患者特殊之处在于两点:(1)患者3个月前感染SARS-CoV-2后发热、咳嗽、咳痰、气短症状反复,短期内复查胸部CT示局灶新发病变此起彼伏,最终长程抗SARS-CoV-2治疗后症状逐渐缓解,复查胸部CT示双肺GGO吸收且未反复,综合考虑患者3个月内反复发热及肺部浸润影为SARS-CoV-2感染所致可能性大。究其原因,与患者既往曾应用CD20单抗、感染SARS-CoV-2时为B细胞清除状态有关。(2)患者2023年2月21日接触甲型流感病毒感染者后亦感染甲型流感病毒,应用抗流感病毒治疗后患者咽拭子核酸转阴后复阳,再次强化抗流感病毒后转阴,该过程提示患者甲型流感病毒感染后同样难以清除,需要强化治疗。但患者在两次抗流感病毒治疗期间,虽热峰下降,但仍持续发热,复查胸部影像学仍提示双肺多发游走性渗出影,证明患者症状及胸部影像学不能仅用流感病毒感染解释,结合前后病情及病原学证据,考虑患者在SARS-CoV-2感染过程中合并了甲型流感病毒感染,因两次BALF均未检出甲型流感病毒,故甲型流感病毒导致上呼吸道感染可能性大。相较于普通COVID-19患者,本例患者以多次咽拭子SARS-CoV-2核酸阴性、BALF淋巴细胞比例明显升高、糖皮质激素治疗效果不佳为特征,同时合并甲型流感病毒感染,既往曾诊断“药物相关肺损伤”,这些内容使本例患者临床诊治颇具挑战。
刘敏(放射诊断科):本例患者主要表现为发热伴双肺多发GGO,其中GGO为游走性特征较为特殊,在鉴别诊断方面主要包括感染性疾病和非感染性疾病。患者因淋巴瘤曾应用抗CD20单抗治疗,入院后查B细胞计数为0,为免疫抑制宿主,且患病以来反复应用剂量不等糖皮质激素,加剧了免疫抑制状态,在感染性疾病方面,需警惕肺孢子菌、巨细胞病毒性肺炎等机会性感染,同时患者曾感染SARS-CoV-2,近期同时患甲型流感病毒感染,肺内浸润影也需警惕此两种病毒所致肺炎。感染性疾病表现为游走性GGO较少见,一些少见情况下SARS-CoV-2感染可以表现出该特征[1]。非感染性疾病方面,游走性GGO特征常提示隐源性机化性肺炎、嗜酸性粒细胞性肺炎、ANCA相关性血管炎等疾病,患者既往曾因应用奥妥珠单抗出现“药物相关肺损伤”,糖皮质激素治疗后缓解,药物相关肺损伤也可能表现为游走性GGO。患者入院后两次BALF均提示淋巴细胞比例明显升高,除外嗜酸性粒细胞性肺炎;肺活检病理未见机化性肺炎表现,除外隐源性机化性肺炎;第一次入院后查ANCA阴性,病理亦无血管炎提示,除外ANCA相关性血管炎;本次入院前患者曾应用大剂量糖皮质激素治疗,肺浸润影吸收不显著,不支持药物相关肺损伤。最终,患者在第二次行支气管镜检查后通过mNGS病原学及深部痰SARS-CoV-2核酸明确诊断SARS-CoV-2感染所致肺炎,应用长程抗病毒治疗后症状缓解,肺部浸润影吸收。
赵玲(病理科):本例患者第二次支气管镜检查时行TBLC,标本病理所见多数肺泡结构正常,部分肺泡间隔稍宽,间质内慢性炎细胞、主要是淋巴细胞少量浸润,Ⅱ型肺泡上皮修复增生。肺泡上皮增生是SARS-CoV-2病毒性肺炎的常见表现[2],本质是SARS-CoV-2感染肺泡上皮细胞后造成上皮细胞损伤、坏死和脱落,机体为修复肺泡上皮损伤出现肺泡上皮增生。该表现并非SARS-CoV-2病毒性肺炎特有,几乎在所有导致肺泡上皮损伤的疾病中均可见到,包括感染性疾病和非感染性疾病[3]。本例患者的鉴别诊断之一是药物相关肺损伤,其病理特征亦为肺泡上皮增生,可伴有肺泡间隔增宽和(或)纤维化改变,一些特殊的药物相关肺损伤存在特殊表现如胺碘酮中毒可见到肺泡内泡沫细胞聚集,但更多为非特异性表现。因此,本例患者在肺病理常规染色中无法鉴别SARS-CoV-2病毒性肺炎和药物相关肺损伤,前者需要结合病原学证据、后者需要结合临床用药的因果关系诊断。本例患者最终诊断为SARS-CoV-2病毒性肺炎,电镜检查如在肺泡上皮中查见病毒颗粒可作为鉴别点[4],但电镜非常规开展项目。
王业明(呼吸与危重症医学科):SARS-CoV-2感染后引起的宿主免疫反应机制仍未被充分阐明。整体而言,正常人在感染SARS-CoV-2后,机体会在6~10 d内获得适应性免疫并清除体内病毒,同时获得免疫记忆。CD4+T细胞具有分化成一系列辅助细胞和效应细胞的能力,能够指导B细胞产生中和抗体、帮助激活CD8+T细胞发挥效用[5]。病毒特异性CD4+和CD8+T细胞、B细胞协同作用最终实现体内SARS-CoV-2的清除。本例患者为B细胞清除患者,不能产生中和抗体,患者在确诊SARS-CoV-2肺炎时测SARS-CoV-2 IgM及IgG均阴性,验证了患者存在明确的体液免疫缺陷,这意味着机体清除SARS-CoV-2能力下降。既往研究显示,癌症患者中SARS-CoV-2感染延长的主要预测因素是体液免疫应答的缺失[6],仅存在活化T细胞不足彻底清除SARS-CoV-2,但关键机制仍有待进一步研究[7]。
曹彬(呼吸与危重症医学科):本例患者是一例特殊的SARS-CoV-2病毒性肺炎患者,既往已有充足证据证明免疫缺陷患者清除病毒的时间显著延长,对于体液免疫缺陷患者尤甚。B细胞清除COVID-19患者发生重症的比例更高,住院时间更长,预后更差[8]。国外学者曾多次报道B细胞清除患者存在有或无症状的SARS-CoV-2感染时间延长,最长可达200余天[9, 10, 11, 12, 13, 14, 15]。如何定义这种感染现象?国外学者选择“persistent”“prolonged”等词汇形容这种感染状态,本例患者或可参考这一描述称为SARS-CoV-2“持续”或“迁延”感染,但其定义仍不明确。结合既往病毒动力学研究[16, 17],我们认为,如患者存在间隔2个月以上的上呼吸道和(或)下呼吸道SARS-CoV-2核酸阳性,且期间有持续的符合SARS-CoV-2感染的症状和胸部影像学变化,或可定义为SARS-CoV-2“持续”或“迁延”感染。当然,这一定义仍需要更多研究证实其准确性与合理性。同时,诊断前应除外患者为二次感染。不同研究中二次感染定义为间隔30~90 d,同时需结合不同SARS-CoV-2变异株的流行病学确定[18, 19, 20]。回归本例患者,追溯2022年12月20日感染SARS-CoV-2变异株类型已不可及,但本例患者2023年3月23日BALF mNGS检测到的SARS-CoV-2为Omicron BF.7.14亚分支,为2022年底北京地区SARS-CoV-2常见流行变异株[21],该亚分支从2023年3月开始占比逐渐降低,或为该患者SARS-CoV-2“持续”或“迁延”感染的侧面提示点。
本例患者相较于国外报道仍有特殊表现:(1)反复咽拭子SARS-CoV-2核酸阴性,可能与患者上呼吸道和下呼吸道病毒脱落水平不同有关,有研究显示上呼吸道SARS-CoV-2脱落常在感染早期达峰,之后逐渐下降[22]。(2)短期内肺部浸润影呈游走性特征,并非SARS-CoV-2感染致肺炎的常见表现。这些表现均可导致这类特殊SARS-CoV-2病毒性肺炎患者被漏诊、误诊。
由于自身体液免疫缺陷,该类患者的治疗颇具挑战,目前尚无标准治疗方案,亦无前瞻性研究提供证据支持。本例患者仅应用Paxlovid且延长抗病毒治疗时程为15 d(3个疗程),同时尽快减量糖皮质激素,基于如下考量:(1)患者初始感染SARS-CoV-2后曾应用标准疗程Paxlovid,且多次应用糖皮质激素,但结果是患者病情不缓解。(2)国外有学者曾报道应用CD20单抗后SARS-CoV-2持续感染或复发患者使用Paxlovid治疗成功案例[23]。(3)患者体液免疫缺陷,SARS-CoV-2可能为“持续”或“迁延”感染,国外学者报道了该类患者中延长Paxlovid应用时间成功控制感染的案例,具体疗程为15~21 d不等[24, 25]。本例患者抗病毒3 d后测深部痰SARS-CoV-2核酸转阴,但当时核酸阳性的cut-off值为35,意味着之后患者深部痰标本真正转阴时间无法确定。患者应用Paxlovid 3个疗程后发热、呼吸道症状基本消失且未反复,故停药。(4)本例患者在本中心诊治类似患者中相对病情较轻,也有一些患者单药抗病毒时上呼吸道和(或)下呼吸道SARS-CoV-2核酸持续不转阴,这些患者正尝试长程、双联抗病毒(3CL蛋白酶抑制剂联合RdRp酶抑制剂)、部分联合恢复期血浆或中和抗体的治疗方案。国外有报道显示抗病毒联合恢复期血浆或中和抗体可能是有效的治疗手段[10,13]。需要指出,SARS-CoV-2“持续”或“迁延”感染的最佳治疗手段目前仍在探索中,治疗终点的确定仍然是临床难题。基于已有的经验,该类患者的长程抗病毒治疗疗程应是个性化的。
B细胞清除治疗包括CD20单抗、CD19靶向CAR-T已广泛应用于血液系统肿瘤及自身免疫性疾病。我国抗疫政策调整后,绝大多数人口均感染SARS-CoV-2,其中在病毒感染前应用B细胞清除治疗的患者均可能面临“持续”或“迁延”SARS-CoV-2感染的风险。该感染状态下这类患者又难免面临原发病无法控制的难题。本例患者的诊疗过程为该类患者的临床管理提供了一定思路,未来仍需更多研究提供治疗依据,以尽可能改善患者预后。
参考文献(略)
作者:王诗尧 王业明 刘敏 赵玲 曹彬;单位:国家呼吸医学中心 呼吸和共病全国重点实验室 国家呼吸疾病临床研究中心 中国医学科学院呼吸病学研究院 中日友好医院呼吸中心 呼吸与危重症医学科;中日友好医院放射诊断科;中日友好医院病理科
引用本文: 王诗尧, 王业明, 刘敏, 等. B细胞清除治疗后新型冠状病毒感染致双肺游走性磨玻璃影 [J] . 中华结核和呼吸杂志, 2023, 46(12) : 1233-1239. DOI: 10.3760/cma.j.cn112147-20230809-00061.
* 文章仅供医疗卫生相关从业者阅读参考