
胡春梅
南京市第二医院
副主任医师 结核病科
医学博士,南京市公共卫生医疗中心结核一科副主任,中国医促会结核病防治分会全国耐药学组委员,中国医师协会呼吸病分会青年委员,江苏省医学会结核病分会青年委员,从事结核病临床工作10余年,熟练掌握肺结核及相关疾病的诊治、耐药肺结核的多学科综合治疗,擅长气管镜下介入治疗支气管结核等
摘 要
因临床的复杂多样,继发性机化性肺炎(SOP)与隐源性机化性肺炎(COP)有时很难鉴别。结核分枝杆菌感染引起的SOP非常少见;至今还没有播散性结核病引起SOP相关报道。
2016年1月-2018年12月,我们诊断了6例结核病相关SOP,病原微生物检查都找到了结核分枝杆菌;其中1例是粟粒播散性肺结核。
6 例病例中,痰涂片抗酸染色(AFB)阳性率为17%, 但通过结核分枝杆菌聚合酶链反应(结核分枝杆菌PCR)和结核分枝杆菌培养阳性率为100%。所有病例均进行经支气管肺活检,病理诊断为机化性肺炎,经抗结核治疗后全部存活。
经肺活检病理诊断为OP,查结核分枝杆菌PCR和结核菌培养阳性诊断为肺结核,经对症治疗后预后良好。
【关键词】:肺结核、机化性肺炎、经支气管肺活检
背 景
机化性肺炎(organization pneumonia, OP)病理学定义为肺泡管和肺泡细支气管内填充肉芽组织的息肉样肿块(Masson小体),细支气管内不限定必有 [1,2]。OP分为隐源性(或特发性)机化性肺炎(COP)和继发性机化性肺炎(SOP)。
SOP指有已知病因引起的OP,现明确的病因包括感染、结缔组织病、药物、炎症性肠病、血液系统恶性肿瘤、器官移植和放疗等[2,3]。感染相关的SOP发生在感染性肺炎(如病毒、细菌、真菌或寄生虫)之后[4,5],也有可能由结核分枝杆菌引起,但非常少见[6-9]。迄今为止,播散性结核病引起的SOP尚未报告。2017年,韩国的肺结核发病率为70人/10万,但与肺结核相关的SOP病例只有1例。
因此,本文将报告6例因结核分枝杆菌感染后发生的SOP病例,包括1例播散性结核病,并进行系统的文献复习。
方 法
对2016年1月至2018年12月期间,在大邱天主教大学医学中心呼吸内科就诊经肺活检确诊为OP的85例患者,进行回顾性研究,收集当时的病原微生物结果,确认是否为SOP。85例中SOP有66例(77.6%),其中54例为感染相关SOP (包括肺结核),其次为癌症、放射性损伤、结缔组织病和药物。该研究已获得当地机构审查委员会的批准(No.CR19-069),免知情同意。
通过痰涂片AFB、痰结核分支杆菌培养以及必要时收集支气管冲洗液和肺组织进行结核分枝杆菌PCR,来确诊肺结核。其中,通过不同PCR方法交叉验证,并结合抗酸染色、培养及综合临床来消除PCR假阳性。另外,对AFB阳性的患者,继续完善结核分枝杆菌PCR或结核菌培养来明确是否为结核分枝杆菌感染。
对肺部病灶表现为大片实变影,拟诊肺炎,经对症治疗无好转,我们需要完善肺活检,与其他疾病进行鉴别。
通过肺活检确认6例SOP病例的病因为肺结核。回顾性调查患者的临床症状、吸烟史、基础疾病、用药史、实验室检查结果、胸片、治疗方案、治疗反应、药敏试验(绝对浓度法)、预后和随访12个月。另外我们对所有已报道与肺结核相关的SOP文献进行复习。
结 果
表1总结了肺结核引起继发性OP的6个病例资料。Fig.1描述这些病例的影像学特征。Fig.2呈现肺组织活检的病理组织学征象。Fig 3是治疗前后的胸片(CXR)和胸部CT对比。
表1结核分枝杆菌感染相关的机化性肺炎患者的临床特征
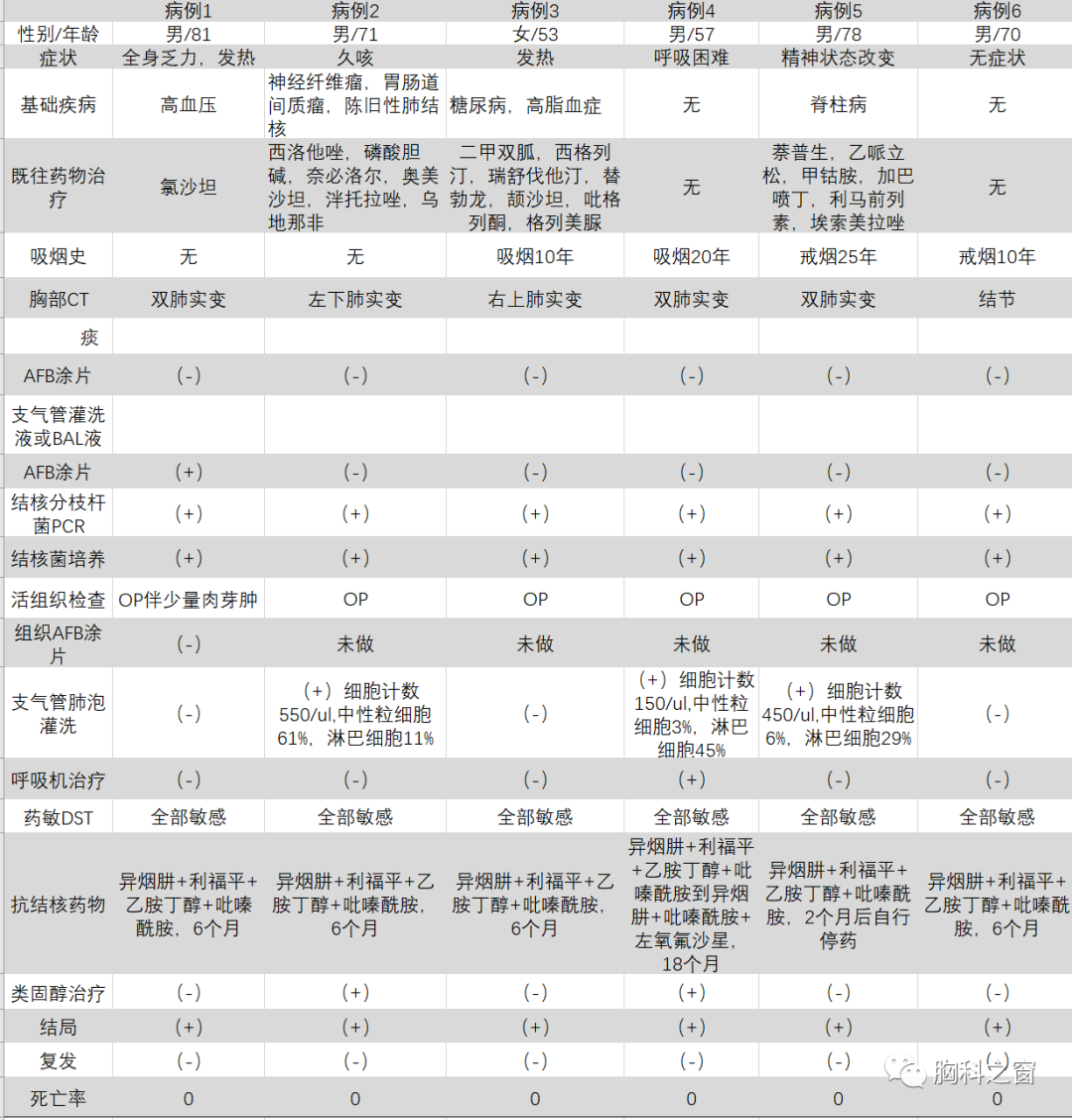
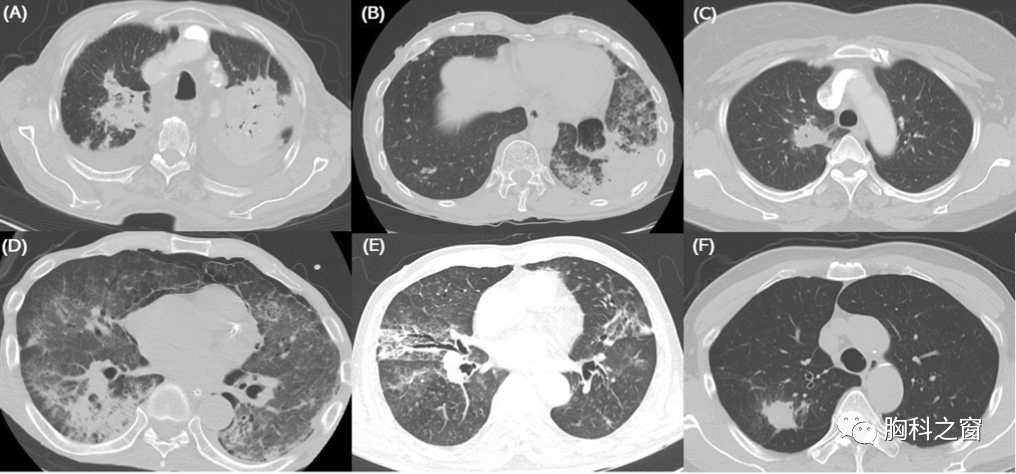
Fig.1 6例患者的胸部CT扫描情况
A:病例1,双肺上叶见实变影和少量胸腔积液,在左肺上叶行经支气管肺活检(TBLB);B:病例2,左肺下叶实变,行TBLB;C:病例3,右肺上叶见厚壁空洞,在局部行TBLB;D:病例4,右肺下叶和左肺下叶都见实变影,在右肺下叶行TBLB;E:病例5,双肺见多发结节和小片状实变影,在右中叶行TBLB;F:病例6,右肺上叶单发结节,行TBLB。
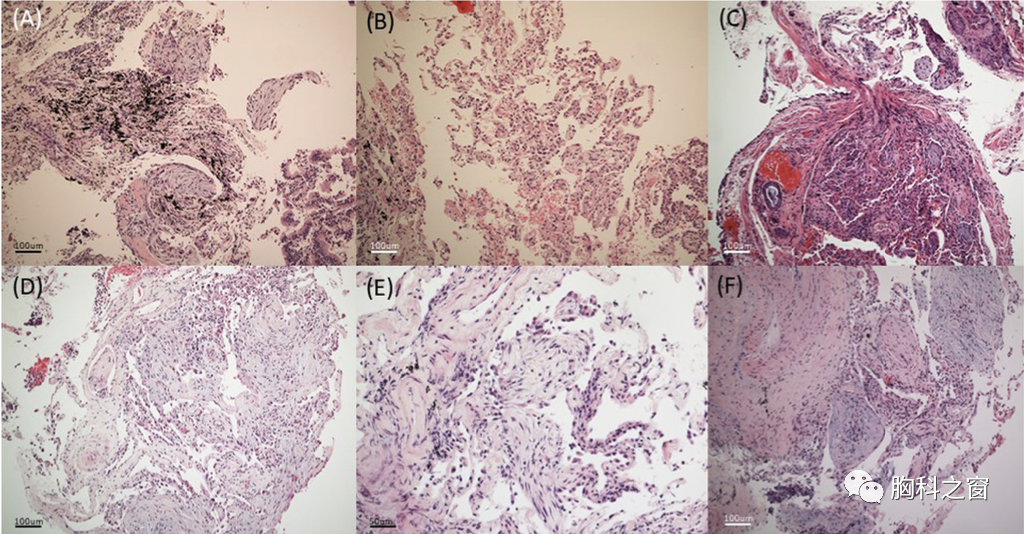
Fig 2 6例经肺组织活检后的病理征象:镜下见在肺泡管和终末细支气管内有肉芽组织的息肉样肿块(Masson小体)填充。
A:病例1;B:病例2;C:病例3;D:病例4;F:病例6,HE染色X100。E:病例5 HE染色X200。
病例1
男性,81岁,因“厌食、发热、咳嗽咳痰3天”就诊。入院查体:BP137/62 mmHg,PR103次/分钟,RR 20次/分钟,T 37.7°C,指脉氧95%。胸部X线检查(Fig. 3a-Pre)和胸部CT(Fig.1a)示两上肺见大片实变影,右肺中下叶局灶性实变影伴双侧胸腔积液。全血细胞计数:WBC 7400/uL(N 81.9%),Hb 9.8 g/dL,ESR 20mm/h,CRP 45.5 mg/L,降钙素原0.14 ng/mL,pro-BNP 1271 pg/mL,血钠130mg/L,血尿素氮5.9 mg/dL,肌酐0.7 mg/dL,白蛋白1.6g/dL,抗HIV抗体阴性。一开始拟诊“社区获得性肺炎”给予抗生素治疗,查痰涂片找抗酸杆菌阴性,但痰结核分枝杆菌PCR阳性,因此诊断肺结核,给予异烟肼、利福平、乙胺丁醇和吡嗪酰胺抗结核治疗。2周后胸部X线复查肺部病灶没有吸收,恶性肿瘤不能排除,于是我们完善了胸部CT,径向支气管内超声(R-EBUS)引导下行支气管肺活检(TBLB)和支气管冲洗。活检病理示OP伴有小肉芽肿(Fig.2A)。同时支气管冲洗液AFB和结核PCR呈阳性,因此继续抗结核治疗。后续的结核菌培养也证实为结核分枝杆菌,药敏提示对所有抗结核药物都敏感。本例治疗中没有使用类固醇激素。在后续胸片(Fig.3A-Post)随访中显示病情有改善。
病例2
患者,72岁,男性,近期因咳嗽痰多,查胸片提示左下肺野(LLLF)局灶性实变影增加来医院就诊(Fig. 3b-Pre)。入院查体BP 120/70 mmHg,PR 90次/min,RR 20次/min,BT 36.6 °C。胸部CT显示 左下肺野实变(Fig. 1b)。白细胞计数为4700/uL(N 58%),Hb 12.6 g/dL,ESR 26 mm/h,CRP 5.3 mg/L,降钙素原0.03 ng/mL,Na 139 m Eq/L,BUN 15.1 mg/dL,Cr 0.8 mg/dL,白蛋白2.8 g/dL。抗HIV抗体筛查 阴性。为了明确肺炎病因,在R-EBUS引导下行TBLB和支气管肺泡灌洗(BAL)。肺活检病理提示OP(Fig. 2b)。支气管冲洗液AFB阴性,结核杆菌PCR阳性。一开始鉴于患者的肺活检和影像学改变均不符合肺结核的相关特征,因此考虑结核杆菌PCR结果为假阳性。于是继续给予患者抗生素治疗,同时增加了皮质类固醇治疗。CXR显示类固醇激素治疗后左下肺野浸润性病灶有改善,但在3周后,BAL液的结核杆菌培养明确结核分枝杆菌生长。因此,停用类固醇激素,开始抗结核治疗。药物敏感试验结果回报对所有抗结核药物敏感,复查胸片见所有病灶均有吸收(Fig.3b-Post)。
病例3
患者女,54岁,因“持续高热4天”,CXR及胸部CT(Fig. 1c)发现右肺上叶(RUL)疑似3.2 × 2.8 cm肿物而转入我院。入院时BP120/70 mmHg,PR 78次/min,RR 20次/min,BT 36.9℃。白细胞计数为7500/uL(N 51.9%),Hb 15.3 g/dL,ESR 6 mm/h,CRP 1.4mg/L,Na 142 m Eq/L,BUN 16 mg/dL,Cr 0.6 mg/dL,白蛋白4.7 g/Dl,抗HIV抗体未查。入院诊断为肺炎,给予抗生素治疗,同时在R-EBUS下进行TBLB和支气管冲洗以排除恶性肿瘤。肺活检病理报告OP(Fig. 2c)。支气管冲洗液AFB阴性,结核杆菌PCR阳性。因此,肺结核诊断明确,给予患者抗结核治疗。后续结核分枝杆菌培养阳性,药敏证实对所有药物敏感。治疗中没有使用类固醇,在抗结核治疗6个月后,复查胸部CT见右肺上叶的结节病灶较前缩小吸收(Fig.3c-Post)。
病例4
患者,57岁,男性,因“全身乏力、呼吸困难3周”急诊入院,入院查BP 134/72 mmHg,PR 118次/min,RR 20次/min,BT 36.1°C,静息下指脉氧饱和度为90%。胸部X线检查(Fig.3d-Pre)和胸部CT显示两肺多发随机分布的微结节,两下肺基底段见散在的斑片影、实变病灶和结节,结节内见空洞,周边伴有磨玻璃影。查白细胞计数为4500/uL(N 93.2%),Hb 14.5 g/dL,ESR 8 mm/hr,CRP 213 mg/L,降钙素原17.65 ng/mL,Na 114 mEq/L,BUN 81.2 mg/dL,Cr 2 mg/dL,白蛋白2.9 g/dL,抗HIV抗体筛查呈阴性,痰液AFB阴性,痰结核杆菌PCR阳性。患者被诊断为粟粒性肺结核和活动性肺结核,接受了抗结核药物治疗(异烟肼+利福平+乙胺丁醇+吡嗪酰胺)。随访胸部CT显示双肺弥漫性实变和磨玻璃影(GGO)增加(Fig.1d)。由于患者持续缺氧,在住院第22天给予机械通气呼吸机治疗。为了寻找病情恶化的病因,我们进行了TBLB(盲检)和BAL。BAL送检AFB为阴性,送结核杆菌PCR检测阳性,肺活检病理证实为OP(Fig.2d)。因此,患者继续抗结核治疗,同时还加用皮质类固醇治疗。随着缺氧渐渐改善和胸部X线复查见病灶吸收,患者在呼吸机治疗第12天后拔管撤机。痰结核分枝杆菌培养阳性,药敏证实对所有抗结核药物敏感。治疗上继续抗结核药物加类固醇激素治疗,激素逐渐减量到6个月时停用,抗结核治疗中因白细胞减少而停用利福平,因视力受损而停用乙胺丁醇,最后予异烟肼+吡嗪酰胺+左氧氟沙星方案维持抗结核治疗18个月停药。后续随访复查胸片见两肺病灶均明显吸收(Fig.3d-Post)。
病例5
患者,78岁,男性,因坐浴时昏倒险些溺水而急诊入院。查BP 100/60mmHg,PR 126/min,RR 23/min,BT 37.8 °C,指脉氧饱和度为83%,(鼻导管吸氧4升/分钟)。胸部CT示疑似肺水肿伴散在的斑片状实变影,双肺多发磨玻璃结节影,呈铺路石征。血白细胞计数5400/uL(N 61.3%),Hb 11.3 g/dL,ESR 6 mm/hr.,CRP 0.6 mg/L,降钙素原13.16 ng/mL,BNP 253 pg/mL,Na 131 mEq/L,BUN 13.1 mg/dL,Cr 0.9 mg/dL。抗HIV抗体筛查试验阴性。患者病史及影像学改变提示肺水肿可能性大,但考虑降钙素原高,持续发热(体温> 37.8°C)。因此,拟诊肺炎可能,在利尿剂治疗同时给予抗生素治疗。胸部X线检查(Fig.3e-Pre)示双肺有新出现的浸润影,故在住院第10天复查胸部CT(Fig.1e),双肺见弥漫性小叶中心结节伴多发聚集而成的较大结节。在R-EBUS下进行TBLB和BAL来寻找病因,BAL液送AFB阴性,结核杆菌PCR阳性,诊断肺结核给予抗结核药物治疗。肺活检病理证实为OP(Fig. 2e),但未给予类固醇激素治疗。BAL液的结核杆菌培养生长结核分枝杆菌,对所有药物均敏感。患者在抗结核治疗2个月后,复查胸片病灶有吸收好转(Fig.3e--2mo Tx),但出现了药物副作用。尽管医生给予相应的对症处理,但患者依从性较差,仍因副反应在2个月后自行停药,终止抗结核治疗。
病例6
患者,70岁,男性,因CXR(Fig.3f-Pre)和CT(Fig.1f)体检发现肺部一个2.7 cm大小 的孤立性肺结节而入院。查BP 121/74 mmHg,PR 62/min,RR 20/min,BT 36.4 °C。血白细胞计数为6200/uL(N 57.8%),Hb 12.1 g/dL,Na 134 mEq/L,BUN 9.7 mg/dL,Cr 0.8 mg/dL,白蛋白4.4 g/dL。抗HIV抗体筛查试验未做。入院后没有使用抗生素治疗,完善经EBUS下TBLB和支气管冲洗。肺活检病理诊断OP(Fig. 2e),支气管冲洗液AFB阴性,结核杆菌PCR阳性,诊断为肺结核给予抗结核治疗。BAL结核杆菌培养生长阳性,对所有药物均敏感。治疗中没有使用类固醇激素,经抗结核治疗6个月后,复查胸片示右下肺结节病灶较前缩小(Fig.3f-Post)。
Fig.3:6例病例治疗前后的胸部图像改变
A:病例1;B:病例2;C:病例3;D:病例4;E:病例5;F:病例6。
注:-Pre表示治疗前,-Post表示治疗后,E-2mo Tx指病例5治疗2个月的胸片
表2结核分枝杆菌感染相关机化性肺炎病例文献复习
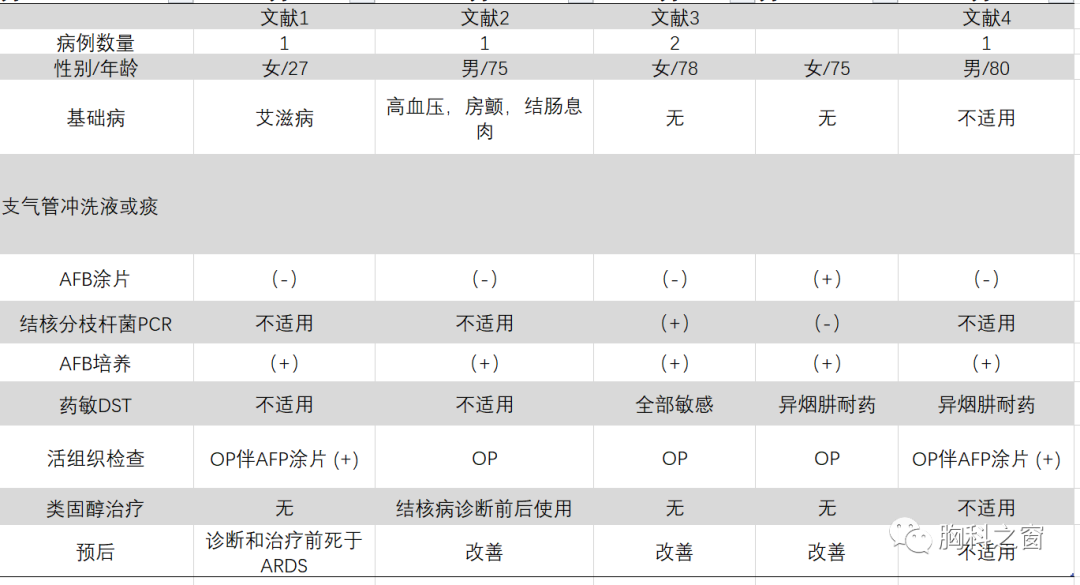
讨 论
结 论
肺结核可能是SOP的一个病因。在结核病高发地区,如果肺活检结果为OP,我们需要完善结核相关检查,尤其是结核分枝杆菌PCR检查,这将有助于肺结核相关OP的早期诊断和治疗,肺结核相关的OP预后良好。
END
参考文献:
1. European RS, Society AT. American Thoracic Society/European Respiratory Society international multidisciplinary consensus classification of the idiopathic interstitial pneumonias. This joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS executive committee, June 2001. Am J Respir Crit Care Med. 2002;165(2):277.
2. Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA. Bronchiolitis obliterans organizing pneumonia. N Engl J Med. 1985;312(3):152–8.
3. Epler GR. Bronchiolitis obliterans organizing pneumonia, 25 years: a variety of causes, but what are the treatment options? Expert Rev Respir Med. 2011;5(3):353–61.
4. Cordier J. Cryptogenic organising pneumonia. Eur Respir J. 2006;28(2):422.
5. Drakopanagiotakis F, Polychronopoulos V, Judson MA. Organizing pneumonia. Am J Med Sci. 2008;335(1):34–9.
6. Lawn SD, Wainwright H, Orrell C. Fatal unmasking tuberculosis immune reconstitution disease with bronchiolitis obliterans organizing pneumonia: the role of macrophages. AIDS. 2009;23(1):143–5.
7. Sander R, Gómez C, Borderías L. Organizing pneumonia and pulmonary tuberculosis: coexistent or associated diseases. Archivos Bronconeumol (English Edition). 2016;52(11):570–1.
8. Yoon HS, Lee EJ, Lee JY, Chon GR, Lee SH, Kim SJ. Organizing pneumonia associated with M ycobacterium tuberculosis infection. Respirol Case Rep. 2015;3(4):128–31.
9. Hsieh M-H, Lin C-Y. Pulmonary tuberculosis presenting as organizing pneumonia. Am J Respir Crit Care Med. 2014;189(9):e63.
10. Baque-Juston M, Pellegrin A, Leroy S, Marquette CH, Padovani B. Organizing pneumonia: what is it? A conceptual approach and pictorial review. Diagn Interv Imaging. 2014;95(9):771–7.
11. Gómez-Gómez A, Martínez-Martínez R, Gotway MB. Organizing pneumonia associated with swine-origin influenza a H1N1 2009 viral infection. Am J Roentgenol. 2011;196(1):W103–4.
12. Roberton BJ, Hansell DM. Organizing pneumonia: a kaleidoscope of concepts and morphologies. Eur Radiol. 2011;21(11):2244.
13. Alasaly K, Muller N, Ostrow DN, Champion P, Fitz Gerald JM. Cryptogenic organizing pneumonia. A report of 25 cases and a review of the literature. Medicine (Baltimore). 1995;74(4):201–11.
14. Sen T, Udwadia ZF. Cryptogenic organizing pneumonia: clinical profile in a series of 34 admitted patients in a hospital in India. J Assoc Physicians India. 2008;56:229–32.
15. Kim EJ. A tuberculosis-associated Endobronchial polyp that was negative for acid-fast Bacillus. Intern Med. 2018;57(18):2701–4.
16. Kim EJ, Kim KC. Utility of radial probe Endobronchial ultrasound-guided Transbronchial lung biopsy in diffuse lung lesions. Tuberc Respir Dis. 2019; 82(3):201–10.
17. Ma M, Li Y, Cai H-R, Ding J-J, Wang Y-S, Gao Y-J, Dai J-H, Zhao Q, Xiao Y-L, Meng F-Q. Radial probe Endobronchial ultrasound-guided lung biopsy for Histopathological diagnosis of cryptogenic organizing pneumonia. Chin Med J. 2017;130(2):236.
18. Lazor R, Vandevenne A, Pelletier A, Leclerc P, Court-Fortune I, Cordier JF.Cryptogenic organizing pneumonia. Characteristics of relapses in a series of 48 patients. The Groupe d’Etudes et de Recherche sur les Maladles “Orphelines” Pulmonaires (GERM“O”P). Am J Respir Crit Care Med. 2000; 162(2 Pt 1):571–7.
19. Li Y, Li Y, Han F, Yu H, Yang T, Li H, Guan W, Guo X. Case report cryptogenic organising pneumonia: clinical, pathological, and prognostic analysis of 27 cases. Int J Clin Exp Med. 2016;9(3):6911–9.
20. Lee JW, Lee KS, Lee HY, Chung MP, Yi CA, Kim TS, Chung MJ. Cryptogenic organizing pneumonia: serial high-resolution CT findings in 22 patients. Am J Roentgenol. 2010;195(4):916–22.
21. Ernst JD. The immunological life cycle of tuberculosis. Nat Rev Immunol.2012;12(8):581–91.
22. Johnson J, Turk T, MacDonald F. Corticosteroids in pulmonary tuberculosis:II. Importance of background factors. Am Rev Respir Dis. 1967;96(1):43–61.
23. Smego R, Ahmed N. A systematic review of the adjunctive use of systemic corticosteroids for pulmonary tuberculosis. Int J Tuberc Lung Dis. 2003;7(3):208–13.
24. Huseby JS, Hudson LD. Miliary tuberculosis and adult respiratory distress syndrome. Ann Intern Med. 1976;85(5):609–11.
25. Murray and Nadel’s Textbook of Respiratory Medicine, 20ed. 2016, 35:593–628.
26. Flynn J, Chan J, Lin P. Macrophages and control of granulomatous inflammation in tuberculosis. Mucosal Immunol. 2011;4(3):271.
27. Rubin EJ. The granuloma in tuberculosis—friend or foe? N Engl J Med. 2009; 360(23):2471–3.
28. Huo Z, Feng R, Tian X, Zhang H, Huo L, Liu H. Clinicopathological findings of focal organizing pneumonia: a retrospective study of 37 cases. Int J Clin Exp Pathol. 2015;8(1):511–6.
图文编辑:依依



