文献来自:Bartlett EC, Renzoni EA, Sivarasan N, et al. Imaging of Lung Disease Associated with Connective Tissue Disease. Semin Respir Crit Care Med. 2022 Dec;43(6):809-824. doi: 10.1055/s-0042-1755566. Epub 2022 Oct 28.

摘要
众所周知结缔组织疾病 (CTD) 与肺部疾病之间存在相关性。除了间质性肺疾病外,CTD 还可能影响气腔和肺血管系统。对于这些复杂性疾病,影像学检查不仅在诊断方面很重要,而且在管理方面也很重要。在本综述中,讨论了 CTD 相关疾病的影像关键点。
关键词:结缔组织疾病;放射学; CT;高分辨率 CT;肺部疾病
结缔组织疾病 (CTD),也称为“胶原血管疾病”,是复杂的免疫介导的疾病,可能会影响多个器官系统。肺部受累——主要是间质性肺疾病(ILD)——是CTD患者发病和死亡的主要原因,这对风湿病学家、肺科医生和放射科医生具有重要意义[1–6]。准确的 CTD 相关性 ILD (CTD-ILD) 放射学特征很重要,原因有几个。首先,影像学可以确定肺部疾病的潜在病理模式,这些模式在反映“特发性间质性肺炎”(IIP) [6 ]的同时,在患病率以及治疗策略和预后方面有所不同。随后,评估疾病范围及其严重程度可能会为基线治疗决策提供信息,并在连续评估时提供有用的预后信息[7-9 ]。其次,高分辨率计算机断层扫描 (HRCT) 提供了这种能力识别可能涉及 CTD-ILD 的不同“解剖室”;例如,尽管气腔和间质疾病最常见,但 CTD 也具有气道和肺血管的倾向。最后,对并发症(特别是急性加重、继发感染、恶性肿瘤和药物反应)的评估可以有助于解释和管理疾病轨迹和症状的意外变化。
本综述考虑了以下七种“主要”CTD 中发生的肺部疾病的影像学特征:(1)类风湿性关节炎 (RA),(2)系统性硬化症 (SSc),(3)多发性肌炎/皮肌炎 (PM/DM),(4)混合性结缔组织病 (MCTD),(5)系统性红斑狼疮 (SLE),(6)干燥综合征 (SjS),以及(7)强直性脊柱炎 (AS)。
结缔组织疾病中间质性肺病的模式
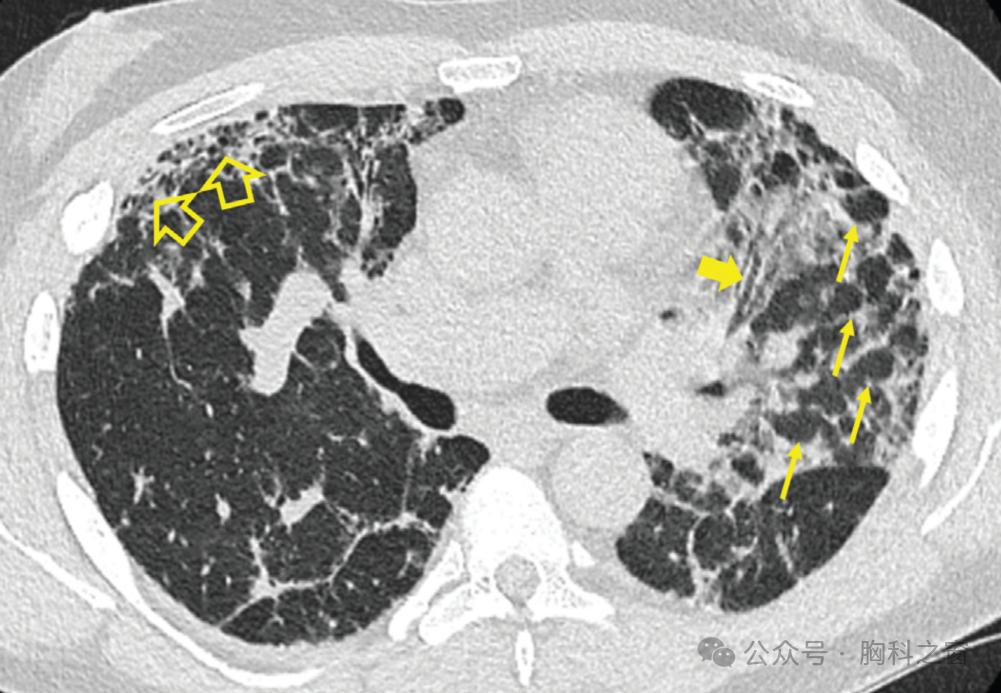
如上所述,CTD患者的肺部疾病病理模式与IIP患者没有什么不同[10]。也就是说,个体模式的发生在很大程度上取决于 CTD 的亚型。总体而言,非特异性间质性肺炎(NSIP)可能是CTDs中最常见的ILD模式;在HRCT上,NSIP模式的特征是基底部为主的磨玻璃样混浊影,伴有或不伴有纤维化迹象[11,12]。尽管以前分为“细胞”和“纤维化”形式,但后者迄今为止最常见[13-15]。与细胞形式相比,纤维化 NSIP 中的毛玻璃样混浊影伴有更广泛的网状化和牵拉性支气管扩张(►图. 1)。蜂窝征是普通间质性肺炎(UIP模式)的一个主要特征,但在NSIP中通常不明显,即使存在蜂窝征,其也不到肺实质的10%[13,16,17]。在2002年美国胸科学会(ATS)/欧洲呼吸学会的IIP分类中,NSIP首次被临时强调为一个可能的病理亚组[10]。此时,NSIP 被认为是一种“废纸篓”模式,不容易与当时公认的其他 IIP 相符合[18]。然而,通过国际多学科方法,ATS 工作组得出结论,NSIP 的特发性形式虽然是一个独特的组织学实体[18],但实际上很少是特发性的,而是通常与潜在的 CTD 相关。因此,例如,Fujita 等在对来自日本队列的 46 例曾被诊断为特发性 NSIP 的患者进行回顾性调查时发现,其中 26 名 (62%) 患有潜在的 CTD[19]。此外,现在人们认识到,即使在那些不符合特定CTD诊断标准的患者中,也有一部分患者具有潜在的自身免疫过程的临床特征,这可能正在驱动ILD[20–22]。Corte等回顾性评估了45例NSIP组织学证据患者的临床和放射学特征,发现14例患者(31%)具有血清自身抗体以及相应的临床特征,表明患有所谓的未分类的结缔组织疾病[20]。最近,术语“具有自身免疫特征的间质性肺炎”(IPAF)已被用于描述那些具有自身免疫特征但不符合所定义的CTD诊断标准的间质肺炎患者(HRCT表现或手术肺活检)[23]。该亚组能否经受住时间的考验还有待观察,因此,目前,IPAF 类性最好被视为一种研究声明。从放射学的角度来看,这种信息可能更简明易懂——如果不是已确定的CTD,NSIP影像模式应该促使对潜在的自身免疫病因进行彻底调查。
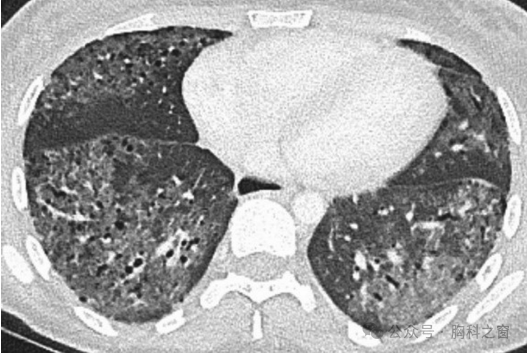
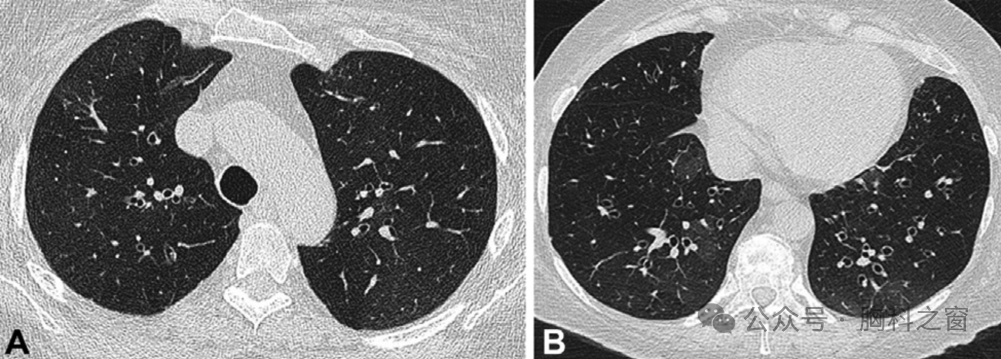
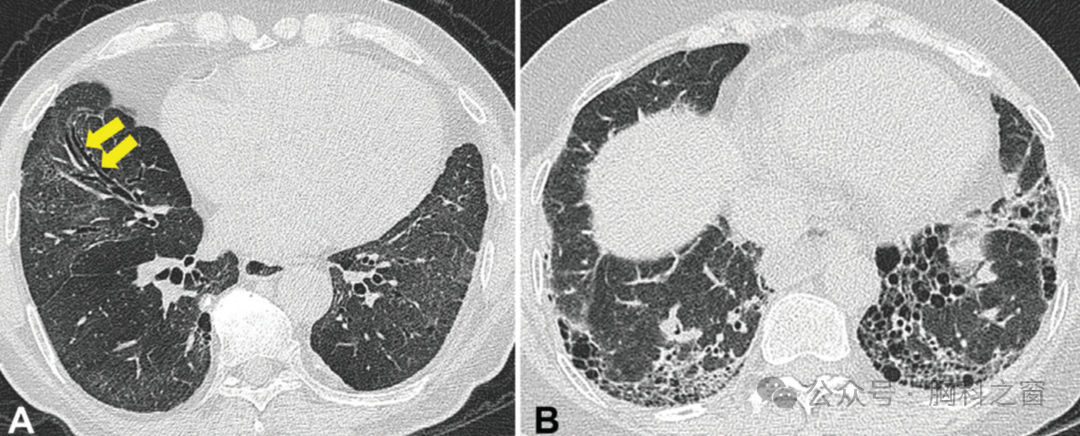
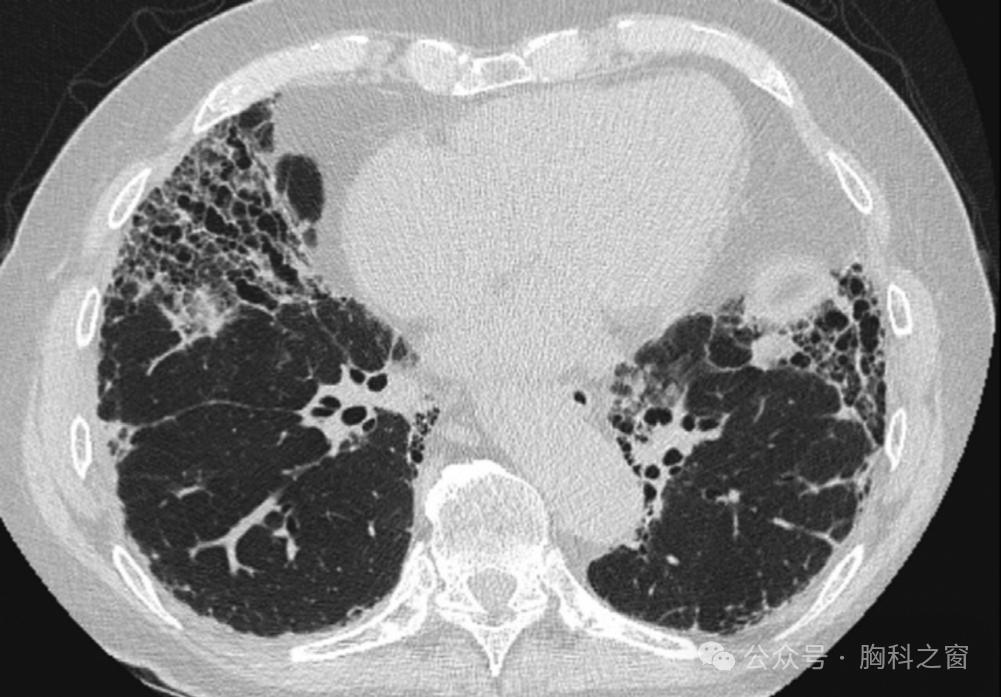
与 SSc 相比,UIP 模式是 RA 患者中最常见的 ILD 形式 (图.2)。在一项针对 181 例 RA 患者的大型研究中,98 例(54%) 在 HRCT 上显示 UIP 模式,而 NSIP 和 OP 模式分别出现在 73 名例(40%) 和 10 例 (6%) 患者中[24]。相比之下,在少数 SSc、SLE、PM/DM 和 SjS 患者中发现了 UIP 模式[25-32]。在 HRCT 上,与特发性肺纤维化 (IPF) 一样,明确的 UIP 模式的特点是基底部为主的胸膜下网状和蜂窝状结构阴影,伴或不伴牵拉性支气管扩张[33,34]。 也就是说,虽然数据相互矛盾,但有人认为,IPF与CTD中的UIP模式对预后的影响可能有所不同。在一项针对362例患者(269例IIP患者,93例CTD-ILD患者)的研究中,与IPF相比,CTD队列中病理性UIP模式其平均生存期显著更长(125.5 ±16个月与66.9 ± 6.5个月)[35]。具有 NSIP 模式的 IIP 组和 CTD 组之间的生存率没有显著性差异。这补充了早期的一项小型研究,在该研究中,与IPF相比,继发于CTD的肺纤维化患者具有生存优势[36]。相比之下,在另一项针对 82 例患者的研究中,RA-UIP 和 IPF-UIP 之间则没有明显的生存差异[37]。上述尽管 CTD-UIP 与 IPF-UIP 之间存在区别,但具有管理意义。在这方面,在一项针对196例患者的大型研究中(CTD-UIP,n=63;IPF-UIP,n=133),Chung等人确定了CTD-UIP中更常见的三种HRCT征象,即“前上叶”、“旺盛蜂窝征”和“直边”征(►图3)[38]。与 IPF 相比,CTD中HRCT 上存在两种或多种这些征象的特异性超过 95%。
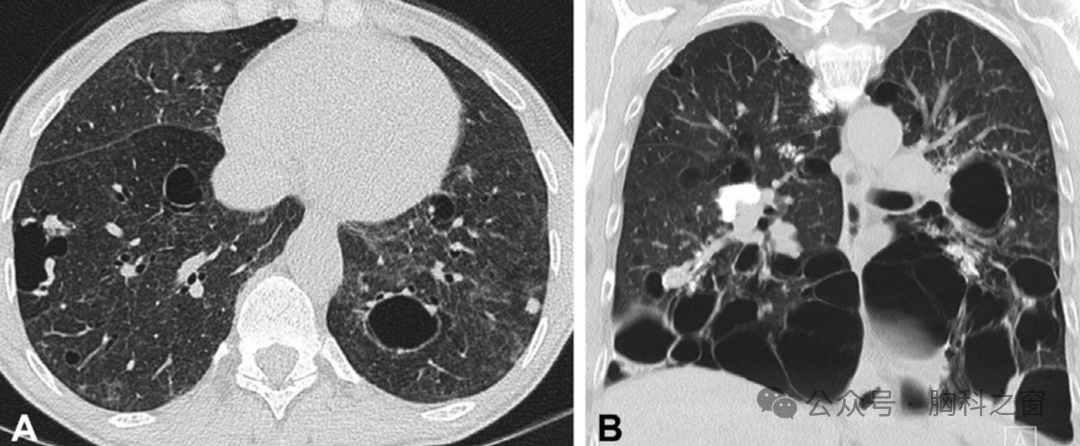
图2.(A,B)1例69岁男性RA相关性间质性肺病的CT。(A)隆突和(B)下叶水平的图像显示了经典的UIP模式。(基底部为主,胸膜下网状影,伴有微囊性蜂窝和牵拉性细支气管扩张。CT、计算机断层扫描;RA、类风湿性关节炎;UIP,普通间质性肺炎。
图3 .RA患者右肺靶向冠状CT重建。存在“旺盛”的蜂窝征的UIP模式。纤维化沿侧面的延伸有限,注意正常肺和异常肺之间的“直边”(箭头)。
机化性肺炎 (OP) 的组织学表现特征是远端气腔内的肉芽组织,是 CTD 相关肺部疾病的另一种重要病理模式[39]。从放射学角度来看,HRCT 上OP 具有多种表现,包括中/下区外周分布的经典实变,但也包括可能以支气管为中心的显著实变影(►图.4),小叶周围分布,有时表现为胸膜下或束带混浊影[40]。
当涵盖所有 CTD 时,OP 是一种相对不常见的组织学模式,但在炎性肌病/抗合成酶综合征中更常见,通常重叠或发展为 NSIP 模式 [41,42]。
结缔组织中的气道疾病
如上所述,在CT中,特别是在RA中,存在一种倾向,即多个解剖隔室(即间质、气道、气腔和/或血管)受到影响。事实上,在HRCT上发现混合模式应该促使放射科医生考虑潜在CTD的可能性。在一项针对 60 例新诊断为 RA患者的研究中,1/5的患者具有气流阻塞的证据,而在 HRCT 上,2/3的患者有低衰减小叶(提示小气道疾病),超过1/3的患者存在支气管扩张[71]。重要的是,气道疾病的形态学征象与阻塞性生理学之间的相关性被证明与吸烟史无关。先前的研究也发现高达 41% 的 RA 患者存在气道疾病,并且通常没有 ILD 。RA 中存在气道疾病,尤其支气管扩张,已被证明其预后不良[72,73]。
SjS 中也可见气道疾病的倾向。滤泡性细支气管炎是SjS最常见的肺实质表现之一,其特征是局限于细支气管和支气管血管周围间质的淋巴浸润[74]。其临床表现与变应性哮喘相似,患者经常主诉干咳、呼吸困难和支气管炎特征。有趣的是,慢性阻塞性肺疾病 (COPD) 也与 SjS 相关。在瑞典队列中,在 11 年随访期结束时,37% 的人被诊断为COPD,而基线时这一比例仅为 7%[75]。诚然,COPD在既往吸烟者(73%)中比从不吸烟者更常见;然而,这些患者在随访期间均未吸烟。同样,在一项包括28000例RA患者的大规模人群研究中,发现疾病队列中COPD的总体发病率高于对照组(分别为5.25人年和3.01/1000人年)[76]。
气道疾病无疑是 CTD 中的一个重要问题,这可能具有预后意义[72,73]。 放射科医生可能首先识别气道受累,表现为支气管扩张或小气道疾病的间接体征[71-74]。
结缔组织性疾病中的血管疾病
特定结缔组织疾病的肺部受累模式
类风湿性关节炎(RA)
RA 是一种常见的炎症性疾病,约占人群的 1% 至 2% [88,89]。自20世纪40年代以来,RA的肺部受累已被公认[90];据报道,RA中具有临床意义的肺部疾病患病率各不相同,但在8%至15%之间[91-93]。无症状RA-ILD的发生率可能要高得多,在一些系列中估计高达44%[88,92,94]。与大多数 CTD(其中 NSIP 模式占主导地位)比较,UIP 模式在 RAILD 患者中最为普遍[37,95–98]。Yamakawa 等最近对 143 例 CTD-ILD 患者进行的一项研究发现,除了 UIP 模式外,上叶前段蜂窝也强烈预示着 RA-ILD 的诊断。在 23 例上叶前段分布的蜂窝状征患者(占 CTD 队列的 16%)中,大多数(23 例患者中的 17 例 [74%])包括 RA 患者,而不是 SSc 或 PM/DM [99]。
RA 中的 UIP 模式具有预后影响 (►图.5)。Kim 等比较了 UIP 或非 UIP 模式的 RA-ILD 患者预后,结果表明前者患者的预后较差,其生存率与 IPF 患者相当[37]。此外,特定的CT特征,即蜂窝征和牵拉性支气管扩张,与生存率较低相关(风险比分别为2.1和2.6)。为了支持这一点,Walsh等还显示,CT上牵拉性支气管扩张的严重程度和蜂窝征的范围是多种CTD死亡率的较强独立决定因素[100]。
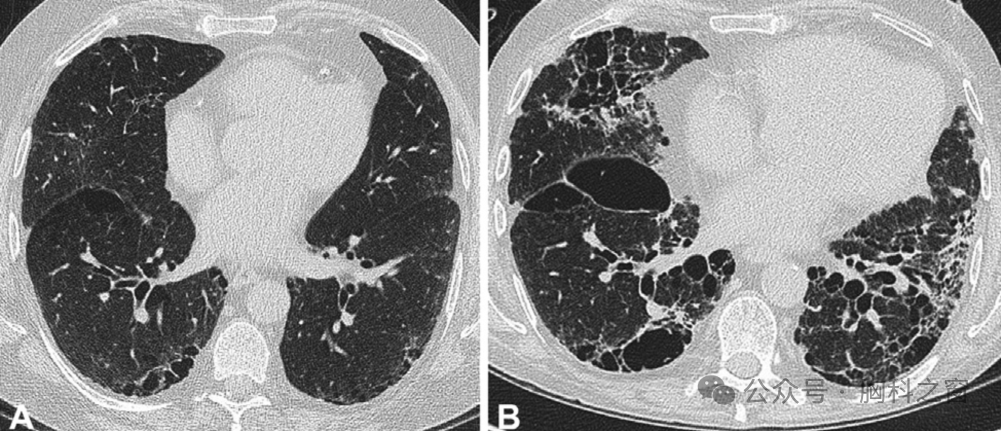
图5.(A,B)2015年(A)和2017年(B)肺静脉汇合处水平的CT影像显示RA纤维化的显著进展。CT、计算机断层扫描;RA,类风湿性关节炎。
放射病理学 NSIP 模式在 RA 中相当常见 [101],但 OP 和 LIP 似乎不太常见 [6,102,103]。毫不奇怪,作为一个整体,考虑到 RA-ILD 中 UIP 和 NSIP 模式发生率较高,网状影、毛玻璃样影、牵拉性支气管扩张、结构扭曲和蜂窝囊肿的存在是 RA-ILD 中最常见的 HRCT 发现[97]。RA-ILD 发生的危险因素包括年龄增长、男性[91]、吸烟史[94,104]、活动性关节病[105]以及类风湿因子和抗环瓜氨酸肽(抗 CCP)抗体血清阳性[94,104]。
香烟烟雾与 RA/RA-ILD 之间存在一个有趣的联系,吸烟被确定为两者的潜在触发因素[104,106]。事实上,尽管RA患者吸烟史很少或没有吸烟史,但CT上仍有肺气肿的报道[107-109];人们很容易推测“不吸烟”RA 相关肺气肿的发病机制中存在自身免疫途径。事实上,在英国和首尔的245例RA-ILD患者中,Jacob等发现27%的从不吸烟者存在肺气肿的CT证据。与没有肺气肿的 RA 患者相比,肺气肿的存在也导致吸烟者和非吸烟者的预后较差[109]。
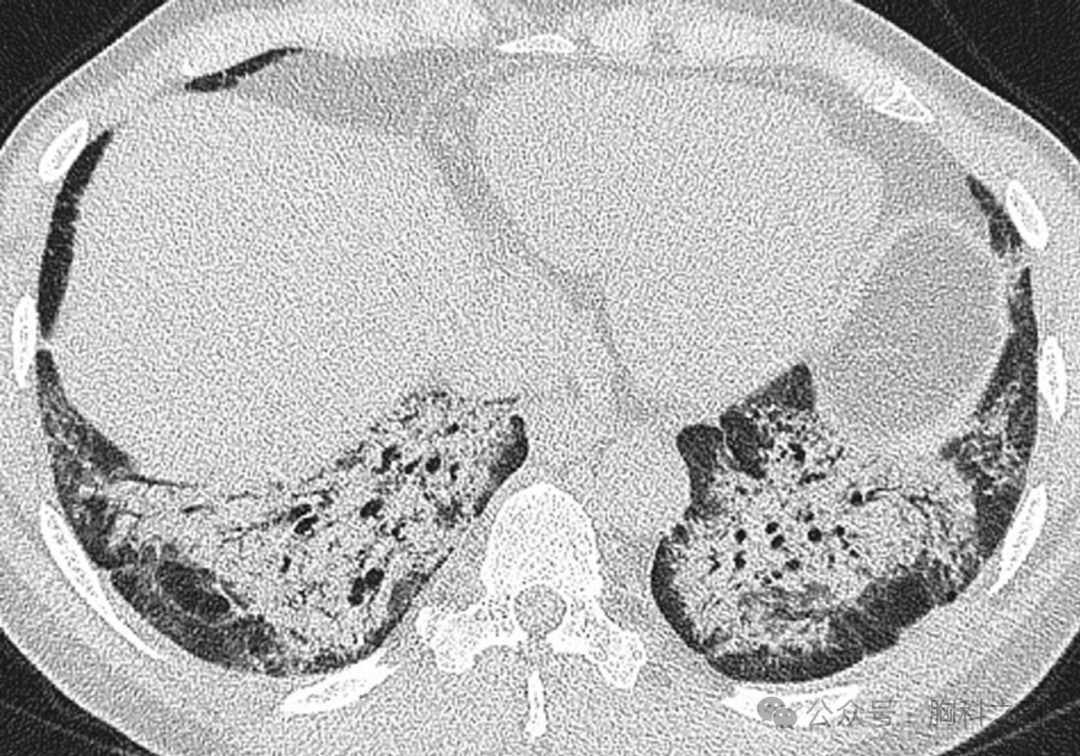
虽然ILD的发展是RA更具破坏性的肺部并发症之一[71,95110],但其只是几种肺部表现之一。气道疾病、血管病变、浆膜炎和淋巴结肿大均已有报道。1977年,Geddes等首次发现RA与气道疾病之间的相关性,他们报道了进行性气道闭塞(由闭塞性细支气管炎[OB]引起)伴气流阻塞(►图6)[111]。在 CT 上,OB 表现为马赛克衰减模式 [33],伴或不伴辅助征象,包括支气管壁增厚和小叶中心结节 [107,112]。随后的研究证实了 OB 和 RA 之间的关联,尽管预后各不相同: 在一个由 41 例 RAOB 患者组成的病例系列中,Lin 等发现,尽管存在严重的气道阻塞和呼吸困难,但在大约 3 年内 FEV1 仅略有下降[112]。相比之下,Devuassoux 等报道在由 25 例重症 OB 患者组成的较小队列中出现快速进展的气道阻塞,40% 的患者在 48.2±49 个月的随访时间内出现慢性呼吸衰竭[107]。
图.6 (A, B) RA 患者的主要气道疾病。(A)上叶和(B)下叶的CT图像显示轻度柱状支气管扩张和轻微但边界清楚的马赛克衰减模式,后者表明广泛的闭塞性细支气管炎。CT、计算机断层扫描;RA,类风湿性关节炎。
RA 的其他以气道为中心的表现包括滤泡性细支气管炎和弥漫性泛细支气管炎(顺便说一句,两者都比 OB 少见)。这些病理实体的非特异性影像学表现包括小叶中心和支气管周围结节,伴或不伴毛玻璃样影[113]。因此,诊断经常基于手术肺活检和组织病理学结果,表明细支气管相关淋巴组织增生[114]。
除了小气道疾病外,RA 还可能影响大气道,表现为支气管扩张和支气管壁增厚,前者发生率高达30%[115]。已经提出了几种理论来解释RA中支气管扩张的存在,包括反复感染的易感性(有时会因生物疾病修饰抗风湿药物(DMARD)而恶化)[116]、自身抗体介导的炎症(特别是瓜氨酸蛋白抗体的抗体[117]),或支气管扩张的遗传易感性,例如,携带囊性纤维化跨膜电导调节基因突变的个体[114,118]。
RA 中的胸膜受累很常见,但据报道,大约 3% 至 5% 的 RA 患者会出现有症状的胸腔积液(反映胸膜炎)[119]。类风湿性胸腔积液的风险因素包括男性、类风湿因子滴度高以及同时存在的类风湿性肺结节[119]。胸腔积液的后遗症包括胸膜增厚和纤维胸。很少发生气胸,通常继发于邻近胸膜的空洞类风湿结节。
在肺部血管腔隙中,RA很少表现为继发于类风湿性血管炎的肺泡出血[85],也很少表现为肺动脉高压,无论是存在还是不存在明显的类风湿性肺纤维化。
最后,尽管很少报道,但在 RA 中仍可发现纵隔和腋窝淋巴结肿大,并且可能反映整体疾病活动,或对潜在 ILD 产生反应[120,121]。
系统性硬化症
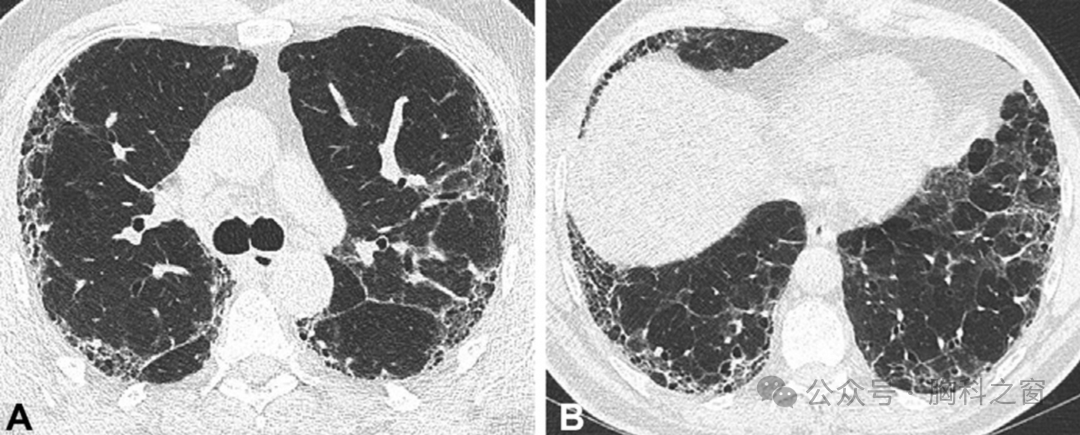
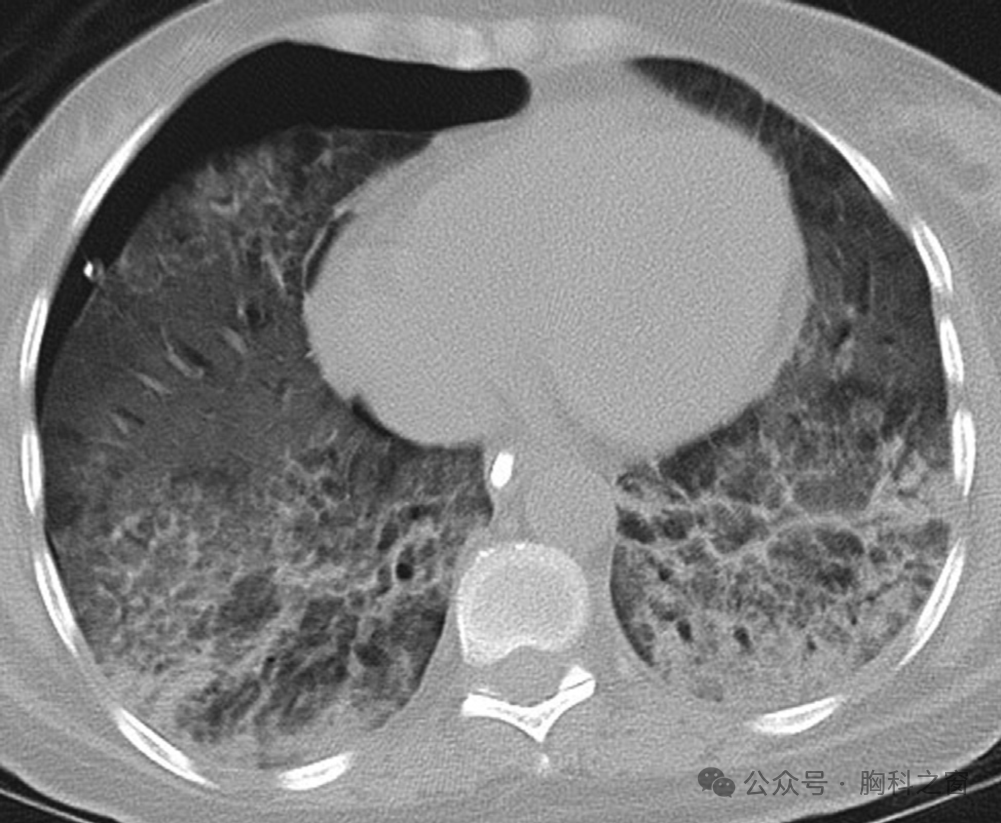
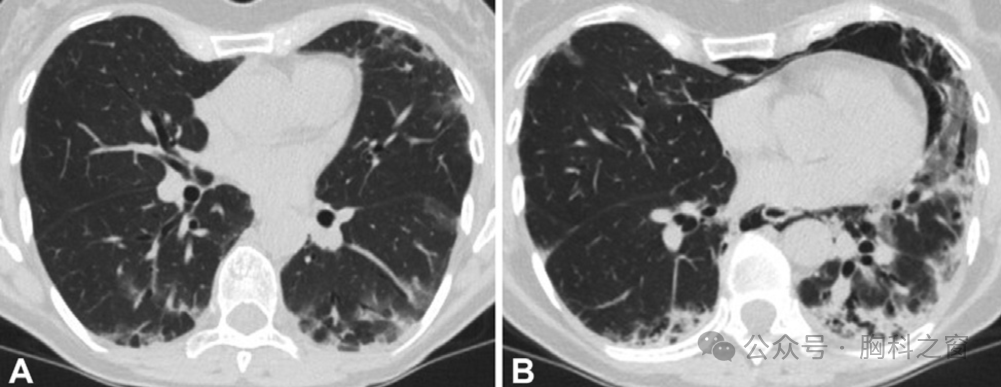
SSc 是一种罕见的 CTD,女性比男性更常见。SSc 的病因尚不清楚,但很可能是由遗传易感个体的环境因素所引发[82,122]。SSc 的两种主要肺部表现,即 ILD 和 PH,导致与该 CTD 相关的高死亡率。SSc 中的肺纤维化很常见,肺部受累可能是该疾病的首发表现[122]。Nihtyanova等在一项针对358例SSc患者的大型研究中报道,刚刚超过一半的患者出现了一定程度的肺纤维化;此外,SSc弥漫性皮肤型的患者可能两倍于局限性皮肤病的患者,其临床上发生明显的纤维化(定义为用力肺活量(FVC)或一氧化碳弥散量(Dlco)预测值为55%或FVC或DICO下降15%)[123]。在SSc特异性自身抗体中,抗拓扑异构酶与ILD的发生密切相关。到目前为止,ILD 的 NSIP 模式在 SSc 中最为普遍,尽管不用说,UIP 模式并不罕见 (►Fig. 7)[12]。然而,蜂窝状的识别,这是一种与UIP纤维化模式密切相关的特征,也在SSc中得到了认可[29,30],尽管其通常程度有限,并混合在磨玻璃影中[29]。
图 7 (A, B). 两例系统性硬化症患者的肺部疾病表现。(A) NSIP 模式显示主要毛玻璃样阴影和细网状影;主要有毛玻璃混浊,主要为GGO伴细小网状影,但没有蜂窝状结构。注意中叶的牵拉性支气管扩张(箭头)。(B) 基底段、胸膜下网状影和蜂窝状 UIP 模式。NSIP;非特异性间质性肺炎;UIP,常见间质性肺炎。
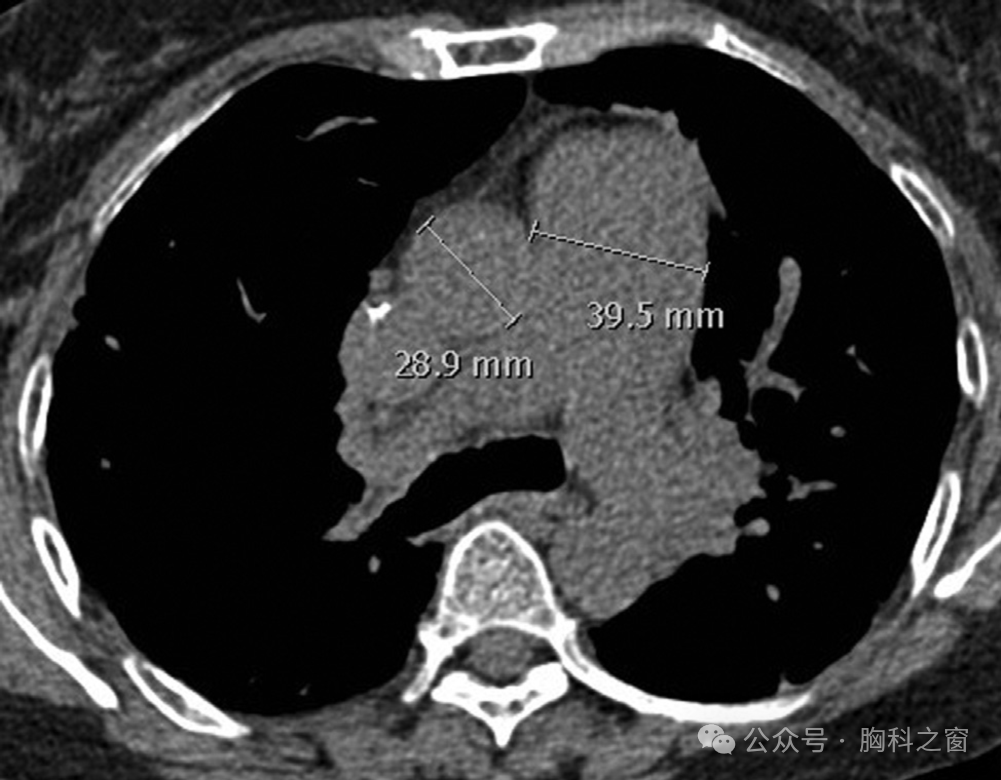
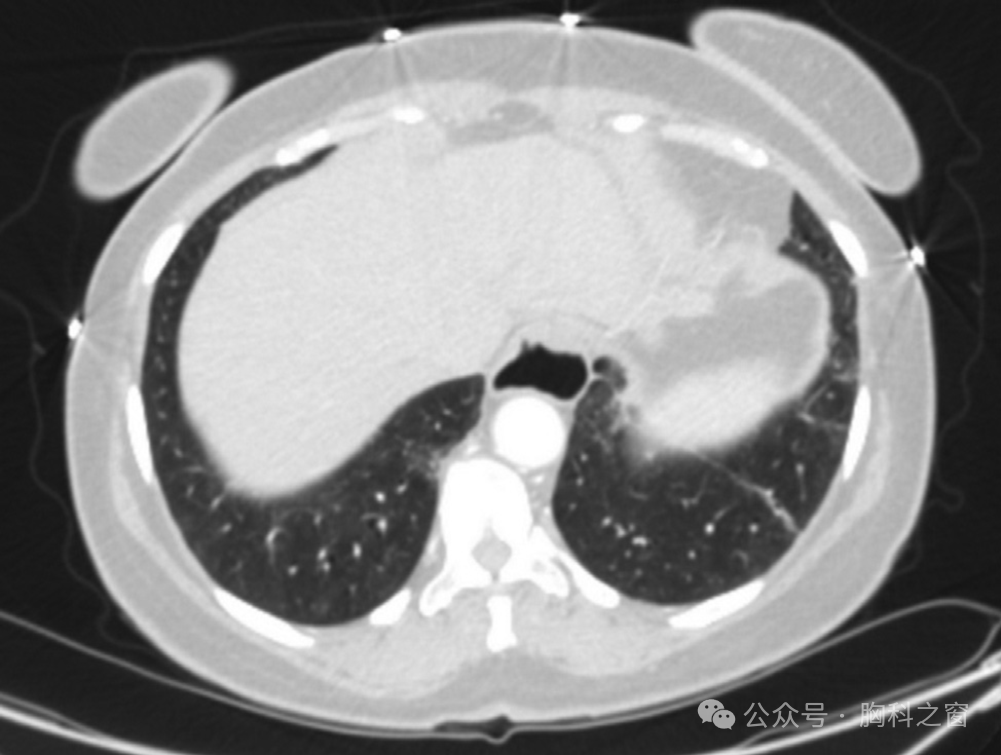
SSc 患者常见的其他辅助影像学特征是食管扩张和 PH 征象,包括肺动脉和右心扩张 (►图.8)。
图 8 . SSc 中的肺动脉高压。非增强 CT 影像显示主肺动脉 (PA) 与升主动脉 (Ao) 横向直径比较,其横径增大: PA:Ao 比率为 40:29。CT,计算机断层扫描; SSc;系统性硬化症。
系统性红斑狼疮
SLE 患者的胸部表现范围非常广泛。然而,与其他主要 CTD 不同,胸膜炎和感染(与 ILD 不同)占主导地位[6,127,128]。事实上,感染与肺外影响(如肾脏疾病、循环系统疾病和癌症)一致被报道为SLE高死亡率的重要原因[129-131]。肺部中SLE的其他不太常见的表现包括急性狼疮性肺炎、DAH、肺动脉高压/血管炎、罕见的慢性ILD以及所谓的肺萎缩综合征。
多达 50% 的 SLE 患者在病程中的某个时间会出现胸腔积液[127,128];积液可能是单侧的或双侧。有时,积液量可能很少且没有临床症状,但患者更常主诉胸膜炎性胸痛和/或咳嗽或呼吸困难[132]。需要进行胸水分析来确认狼疮性胸膜炎的诊断。尽管狼疮性胸膜炎通常呈良性病程,但积液可能会反复出现。
急性狼疮性肺炎是SLE的罕见表现;大多数病例系列报告的患病率最多为 10%[133]。一般来说,表现为急性发烧、低氧血症、呼吸困难和咳嗽。由于急性狼疮性肺炎可能是SLE的初始表现,因此诊断通常具有挑战性。从放射学角度来看,肺炎表现为胸片 (CXR) 上的双侧浸润,伴或不伴胸腔积液 [134]。在CT上,表现反映了DAD, 所以与急性呼吸窘迫综合征患者的表现没有区别;因此,典型的CT表现为双侧、大致对称、广泛的磨玻璃样阴影,密度从前到后呈梯度增加(►图9)。这些表现可能存在感染(感染本身可能是 SLE 急性呼吸窘迫综合征的触发因素[135],需要被视为管理中的潜在促成因素)。与急性狼疮性肺炎相关的死亡率很高:在最近由 5 例急性狼疮性肺炎患者组成的极小病例系列中,死亡率为 40%[136]。
图 9 . CT 显示的急性狼疮性肺炎。显示双侧、大致对称的GGO和依赖性致密实质影。其外观与急性呼吸窘迫综合征患者的外观相似。CT,计算机断层扫描。
DAH 在 SLE 中并不罕见,是 SLE 病程中潜在致命的并发症,有几份报道显示生存率较差(在某些系列中高达 50%)[137]。尽管如此,最近,DAH 患者的前景似乎正在改善。最近一项针对大约 1,000 例患者的大型队列研究显示,有 22 例患者(2.2%)存在 DAH 的证据;所有患者均在急性发作后幸存下来,这可能是在过去 10 至 15 年内出现新的治疗方法[138]。在 DAH 的情况下,单纯 CXR 表现可能在早期阶段不显着,或者充其量呈非特异性;通常,存在双侧气腔渗出影。在 CT 上,存在弥漫性毛玻璃样阴影,伴或不伴实变,通常呈双侧性,且通常肺外周不受累[85]。值得注意的是,没有咯血史不应排除 SLE 的 DAH 诊断。DAH 的常见但呈非特异性症状是呼吸困难和咳嗽[139,140]。
SLE 中的肺动脉高压比其他 CTD 中较少见。在一项针对英国 288 例 SLE 患者的前瞻性横断面研究中,发现 4.2% 的患者患有肺动脉高压[141]。在一项针对新加坡 786 名例SLE 患者的回顾性队列研究中发现了类似的肺动脉高压发病率 (3%) [142]。
SLE 中的慢性 ILD 并不常见,通常隐匿发病,并且通常在 SLE 发病后 10 年以上[133,143]。急性狼疮性肺炎发作后也可能出现慢性肺部疾病[128]。在 HRCT 上,疾病模式通常是 NSIP、NSIP-OP 或 OP [31],或者不太常见的是 LIP 模式 [132]。
肺萎缩综合征是 SLE 的罕见并发症,首次被描述于 20 世纪 60 年代 [144,145]。患者通常主诉呼吸困难和/或胸膜炎性胸痛,并且肺功能为限制性通气功能障碍,但没有肺纤维化[6,127]。可能会出现基底段线性肺不张,极少数情况下会出现胸腔积液或胸膜增厚。在 CXR 和 CT 上,患者的肺容量随着半膈肌的抬高而减少。
炎症性特发性肌病(多肌炎和皮肌炎)
炎症性特发性肌病(IIMs)是一组有趣的炎症性疾病(包括PM、DM、包涵体肌炎和免疫介导的坏死性肌病),其特征是不同程度的骨骼肌炎症加上皮肤、肺或肌肉骨骼系统中不同严重程度的全身并发症[146,147]。两组自身抗体与 IIM、肌炎特异性抗体 (MSA) 和肌炎相关抗体 (MAA) 相关。一些 MSA 与 ILD 的发生有关,包括针对抗氨酰基 tRNA 合成酶的 MSA(通常是抗 Jo1、抗 PL6、抗 PL12、抗 EJ 和抗 OJ;统称为“抗合酶抗体”),MDA-5抗体[147,148]。更广泛的术语“抗合酶综合征”适用于一组检测到抗合酶抗体的PM/DM患者,其中很大一部分患有ILD[28,149]。值得注意的是,抗合成酶抗体可能与 ILD 相关,且肺外特征很少(如果有的话)。与没有抗 ARS 的 ILD 相比,具有抗合成酶自身抗体的 ILD 通常对皮质类固醇有更好的反应,预后也更好 [150,151]。除了快速进展的 ILD 之外,大多数系列患者中 5 年生存率超过 85%[151-153]。抗 MDA-5 抗体仅在 DM 患者中发现,并且与临床无肌病形式的 DM (CADM)[68,147 ]以及有时是灾难性的快速进展 ILD 的发展密切相关[146,154–156]。第二组抗体是在几种 CTD 中发现的MAA,包括抗 Ro52、抗 PM、抗 Scl-75 和抗 Ku,所有这些也与 ILD 的发展相关[147]。
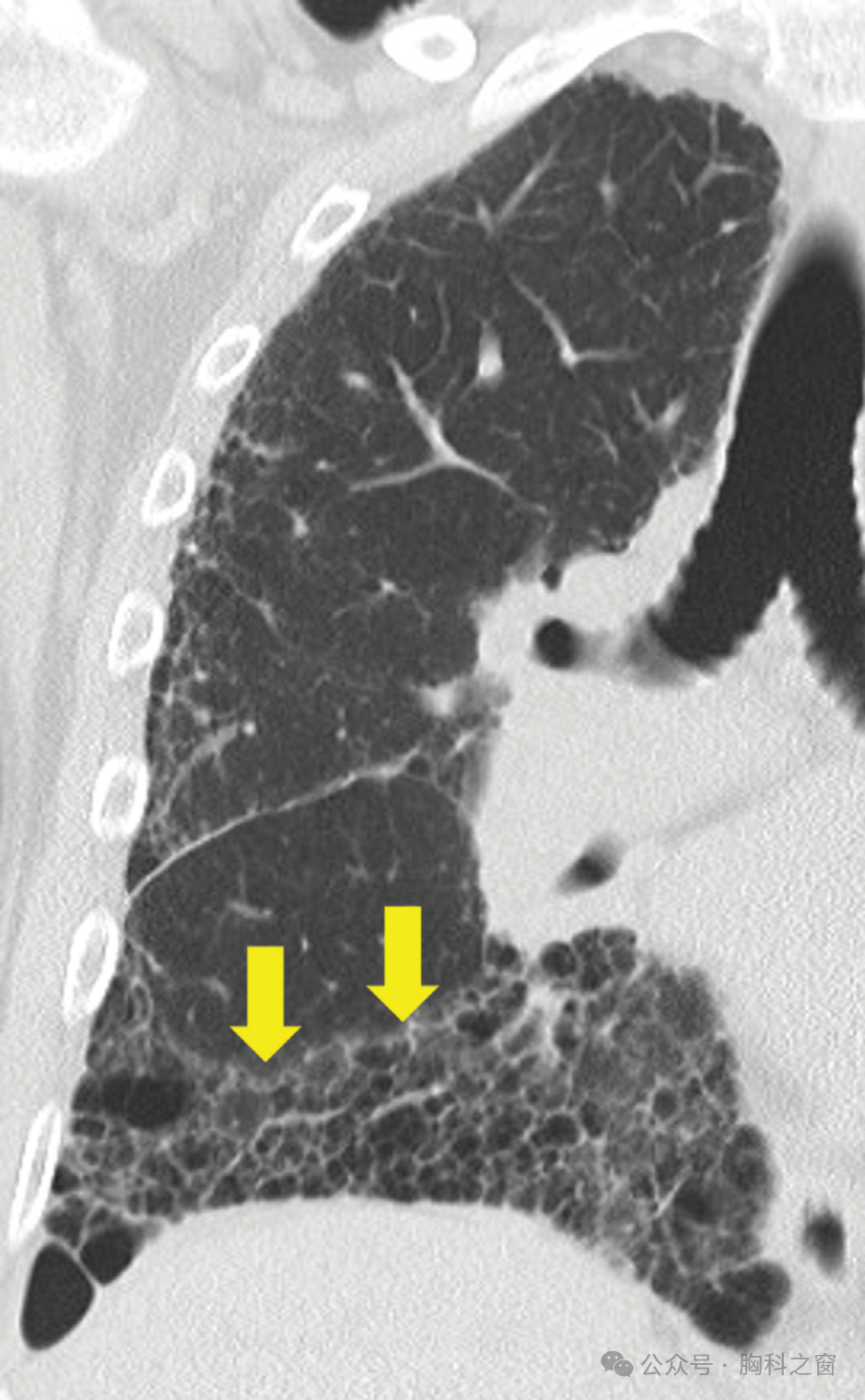
IIM 患者(包括抗合成酶综合征患者)最常观察到的肺部疾病 CT 模式是 OP、NSIP 或 OP-NSIP“重叠” 模式,伴或不伴纤维化征象 (►图10)[ 26–28,152,157]。AIP也有报道[41]。有趣的是,日本的一个研究小组对 88 例抗合成酶相关 ILD(主要是 NSIP 或 NSIP-OP 重叠模式)的患者进行了研究,发现存在中叶牵拉性支气管扩张(►图11)可预测疾病不稳定和肺功能恶化[152]。
图10. 患者70岁,男性,Jo-1 阳性抗合成酶综合征。CT显示左上肺舌段斑片状小叶周围实变(细箭)和牵拉性支气管扩张(粗箭)。右上叶也有纤维化征象,右上叶有胸膜下网状影和微囊性蜂窝状结构(空心箭)。
图11. 患者男性,57岁,Jo-1 阳性抗合成酶综合征; CT显示存在纤维化的 NSIP 模式,但要注意中叶的显着牵拉性支气管扩张。
在抗MDA5阳性CADM患者中观察到一种有趣且不可阻挡的ILD形式,其中在呼吸道症状出现后1至3个月内出现与低氧血症和呼吸困难加重相关的进行性肺部疾病[69,154,158]。在一项对 308 例 IIM 相关快速进展 ILD (n=117) 和慢性 ILD (n=191) 患者进行的大型研究中,快速进展形式的患者在初次就诊时更有可能在 CT 上存在OP 模式(52.1 vs.11.0%,p=0.00),而大多数慢性 ILD 患者 (78%) 呈现 NSIP 模式 [69]。MDA5 阳性 CADM患者与气胸和纵隔气肿之间存在一个有趣的相关性,这种情况经常发生,并且可能预后较差 (►图12)[159,160]。
图 12 (A, B). MDA5 阳性临床无肌病性皮肌炎 (CADM) 中快速进展的 ILD。A. 2017 年 12 月的 CT 显示下肺叶有限的小叶周围实变。B. 2018 年 2 月有快速进展的证据,其中更广泛的实变主要发生在左肺。气道扩张且扭曲(牵拉性支气管扩张),提示纤维化。还要注意广泛的纵隔气肿,这是 MDA5 阳性 CADM 的罕见关联。
混合性结缔组织性疾病
MCTD 的特点是 SLE、SSc 和/或多肌炎;毫不奇怪,MCTD 的特征性临床特征包括手和手指浮肿或肿胀、指端硬化、雷诺现象、多关节炎和肌炎,与U1小核糖核蛋白抗体相关[161-163]。MCTD 患者的 ILD 很常见;过去二十年的几项研究表明,多达三分之二的 MCTD 患者会出现 ILD [162,164,165]。最近的两项研究还发现,存在抗Ro52抗体[164,165]和男性、无关节炎以及抗RNP抗体滴度升高[165]不仅是ILD发生的风险因素,也是其进展的风险因素。正如预期的那样,考虑到临床表型,肺部疾病的放射学模式最常类似于NSIP模式[162166167],较少出现UIP或LIP(►图13)[168]。
图 13. 患者59 岁 ,女性,MCTD的纤维化 NSIP 模式。CT显示双下叶轻微的GGO和牵拉性支气管扩张。注意明显的食管扩张。
在一项对 39 例 MCTD 患者进行为期 10 年随访的研究中,Kawano-Dourado 等评估了 ILD 的长期进展和肺功能趋势,发现两者仅轻微进展,尽管只有超过 50% 的队列在基线时肺功能异常[167]。他们的数据提示,与其他ILD比较,其ILD病程较好,但缺乏长期随访的大量数据[163]。
在这种情况下,除了ILD外,也经常出现肺动脉高压、胸腔积液和食道运动障碍。在一项针对 280 例MCTD 患者的大型研究中,Hajas 等报道,通过放射性核素食管传输闪烁扫描或上消化道造影研究评估,近 40% 的患者存在食管受累[169]。然而,食管受累可能无临床症状或亚临床症状[170],或表现为麻烦的吞咽困难或反复误吸[171]。
干燥综合征
SjS 是一种慢性炎症性疾病,其特征是外分泌腺(主要是泪腺和唾液腺)的淋巴细胞浸润。腺外疾病表现在肺、皮肤和心脏以及神经和肌肉骨骼系统[32,172]。SjS 表现为原发性疾病 (pSjS) 或继发于其他自身免疫性 CTD,例如 RA 和 SLE。在一项大型系统综述中,Qin 等报道SjS 的发病率各不相同,亚洲为 6 至 11.8/100,000 人年,欧洲为 3.9 至 5.3/100,000 人年,总体人群患病率为 60.82 (95% 置信区间:43.69-77.94)/100,000[173 ]。女性发病率较高,女性:男性的患病率比率高达10[72,173],通常出现在围绝经期。
与其他CT一样,SjS的肺部受累可能涉及几个“隔室”,包括间质和气道,较少涉及脉管系统和胸膜。在间质过程中,SjS通常与淋巴细胞间质性肺炎(LIP)相关。 的确,如上所述,在 HRCT 上显示 LIP 的典型 CT 表现,至少应该疑似 SjS 诊断的可能性。在两个小病例系列中,SjS的潜在诊断率为 43 - 53%,伴有 LIP 的组织学和/或放射学征象 [51,174]。一些SjS患者的CT显示,LIP的一个特别显著的表现是存在磨玻璃样阴影,多发薄壁囊肿和淀粉样蛋白的实质结节,这些结节可能钙化,有时位于囊肿附近(►图14)[74]。
尽管如此,与其他几种 CTD 一样,NSIP 模式可能是 SjS 患者 ILP 更常见的表现 [175,176];OP 和 UIP 也相对常见。在最近一项针对 16 例 SjS 患者的小型研究中,尽管 16 例患者中有 11 例 HRCT 诊断为明确的 UIP(9 例患者中有 2 例)或可能 UIP(16 例患者中有 9 例),但 2 /3 患者经HRCT诊断为可能 UIP(9 例患者中有 6 例)最终被诊断为 NSIP。因此,NSIP 是该系列患者中最常见的组织病理学模式,总体上占 56.3% 的患者 [32]。此外,根据一些早期针对 UIP 和 RA 患者[37,177] 以及 UIP 和 SjS[175] 的研究,Kim 等发现明确的 UIP 模式预示着生存低下。
需要强调的是,SjS的一个重要关联是淋巴增殖性恶性肿瘤(最常见的是结外边缘区非霍奇金淋巴瘤[178),发生于5%至10%的SjS患者 [178-180]。HRCT上淋巴瘤的放射学表现呈非特异性,可能表现为单个或多个肺结节或团块、双侧肺泡浸润,甚至气道疾病(支气管壁增厚和支气管扩张)[74180,181]。淋巴瘤可能与淀粉样变性相似或共存,因此,在做出明确诊断之前通常需要进行肺活检[74,182]。
SjS 中的气道疾病常见于上呼吸道以及大气道和小气道。在上呼吸道和大气道中,气管(干燥气管)和大气道(干燥性支气管炎)干燥表现为干咳[181]。几个病例系列报道了细支气管炎、支气管扩张和支气管壁增厚[183-186]。小气道疾病也可能表现为呼气相 CT显示的肺部空气潴留,或马赛克衰减,也得到了很好的认识,但与肺功能指数的相关性较差[187]。气道疾病的其他罕见表现包括滤泡性细支气管炎和渗出性细支气管炎。前者代表一种基于气道、相对惰性的类固醇或免疫抑制剂反应性淋巴增殖性疾病,其特征是存在细支气管周围滤泡性淋巴增生伴反应性生发中心[179,182,188]。滤泡性细支气管炎CT表现为小叶中心或支气管周围结节,伴或不伴毛玻璃样阴影[113,189],而树芽征则提示渗出性细支气管炎。
强直性脊柱炎
AS 是一种罕见的血清阴性 CTD,通常影响脊柱和骶关节。大多数患者在成年早期(通常在 30 岁以下)出现肌肉骨骼症状[190]。AS 大约存在于 0.1% 的人群中,男性显著多于女性,并且与 HLA-B27 抗原阳性密切相关[191]。尽管肌肉骨骼症状出现在生命早期,但该疾病的胸部表现往往出现在以后。有时,胸壁疼痛是 AS 的主要症状[192]。在对 2,080 名例AS 患者进行的早期回顾性调查中,Rosenow 等发现只有 28 例患者(1.3%)存在胸膜受累[193]。随着 HRCT 的出现,感觉胸膜受累更为常见。
AS 中典型且最常见的胸膜肺表现是尖端胸膜增厚、胸膜下纤维化和纤维大疱性疾病,可能无临床症状 [192,194]。通常,这种情况会在几年内缓慢发展,尽管最近的一份病例报道记录了3 年内迅速进展的尖端纤维化 [195]。患者易出现叠加的真菌或分枝杆菌疾病[191,193]以及自发性气胸,气胸可能呈复发性,也可能为双侧[196,197]。
HRCT 的出现使得能够更全面地评估AS 相关的胸膜肺和气道疾病。除了上述发现外,还报道了实质微结节、实质带、支气管壁增厚和支气管扩张[194,198,199]。
结缔组织疾病中药物引起的间质性肺疾病
尽管全面讨论 CTDs 中药物引起的肺部疾病的范围超出了本文的范围,但应简要提及 CTDs 治疗引起的肺部“损伤”的最新进展,特别是与甲氨蝶呤的使用有关。
甲氨蝶呤、DMARD 历来用于治疗 RA,但由于担心肺毒性(表现为炎症性肺炎)和肺纤维化的发展,导致一些患者停止治疗。然而,与长期以来和传统的观点相反,最近一项针对 1,000 多例伴和不伴 ILD 的 RA 患者使用甲氨蝶呤的回顾性病例-对照研究发现,不仅使用甲氨蝶呤与 RA-ILD 发病率较低相关,而且在甲氨蝶呤治疗的患者中较晚发现 ILD [200]。最近的三项前瞻性和回顾性研究也证实甲氨蝶呤与 ILD 的发生和进展无关[201-203]。事实上,有人认为甲氨蝶呤可能会延缓 ILD 的发生[200],尽管仍在等待进一步的数据 [204]。值得注意的是,在 Li 等的研究中,来氟米特是另一种经常用于治疗 RA 的 DMARD,也与 ILD 的发生或进展无关[203]。相比之下,一项早期大型队列研究超过620,00例患者接受DMARD治疗,研究发现,使用来氟米特相关的ILD(肺炎)风险增加两倍,但这仅限于既往ILD或之前接受过甲氨蝶呤治疗的个体[205]。
用于治疗 CTD 并被认为引起肺部疾病的其他药物包括生物制剂,例如细胞因子抑制剂(例如抗 TNF、抗 IL1 和抗 IL6 药物)或抗 B 或 T 细胞淋巴细胞抑制剂[206-208]。在一项针对 122 例生物治疗相关的 ILD 病例的研究中,122 例患者中有 117 名患者的 ILD 发生或恶化与抗 TNF 药物相关[209]。不幸的是,这些病例中只有不到六分之一报道了组织病理学诊断;UIP、NSIP 和 OP(三种最常见的组织病理学诊断)的发现频率相似。其中 50 例患者的 HRCT表现如下:毛玻璃样阴影 (n=31)、网状结节模式 (n=7)、网状模式 (n=5)、结节模式 (n=2) 和蜂窝状结构 (n=8) [209]。
结缔组织疾病中影像学监测的作用
结论
参考文献(略)